维权声明:本文为hhciq原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。
液相色谱-串联质谱法测定河豚鱼及鳗鱼中的林可霉素、竹桃霉素、红
霉素、替米考星、泰乐菌素、螺旋霉素、吉它霉素、交沙霉素残留的研究
摘要 建立了河豚鱼和鳗鱼中林可霉素(lincomycin)、竹桃霉素(oleandomycin)、红霉素(erythromycin)、替米考星(tilmicosin)、泰乐菌素(tylosin)、螺旋霉素(spiramycin)、吉它霉素(kitasamycin)、交沙霉素(josamycin)等8中大环内酯类抗生素残留检测的高效液相色谱-串联质谱分析方法。样品经tris溶液萃取、净化后,用HPLC-MS/MS电喷雾正离子(ESI+)模式电离,多反应监测模式测定,罗红霉素(Roxithromycin)为内标,对河豚鱼和鳗鱼中8中大环内酯类抗生素进行定性和定量。河豚鱼中的8种大环内酯类抗生素和鳗鱼中林可霉素、红霉素、泰乐菌素、吉它霉素浓度在2.0 μg/L~50.0μg/L、鳗鱼中螺旋霉素、竹桃霉素、交沙霉素、替米考星浓度在5.0 μg/L~50.0μg/L范围内呈现良好的线性关系,线性相关系数γ>0.9940。河豚鱼中的8种抗生素和鳗鱼中林可霉素、红霉素、泰乐菌素、吉它霉素方法检出限(LOD)为2.0 μg/kg;鳗鱼中螺旋霉素、竹桃霉素、交沙霉素、替米考星方法检出限(LOD)为5.0µg/kg。回收率在75.4%~124.0%之间。八种大环内酯类抗生素重复性相对标准偏差(RSDr)在1.34%~5.79%之间,再现性相对标准偏差(RSDR)在6.20%~15.27%之间。可以用于河豚鱼和鳗鱼中8种大环内酯类抗生素残留检测的高效液相色谱-串联质谱方法的定性和定量。
河豚鱼和鳗鱼在中国有着悠久的食用历史,营养丰富。由于目前中国的河豚鱼和鳗鱼主要是养殖的,在养殖过程中不可避免使用抗生素用于保护鱼体正常生长。养殖用药主要是林可霉素、竹桃霉素、红霉素、替米考星和泰乐菌素等,该类抗生素通过羟基以苷键与去氧氨基糖或二甲氨基糖缩合成碱性苷[1],作用于细胞核糖体50 S亚单位,阻碍细菌蛋白质合成,有较强的抗菌活性[2]。曾广泛应用于食用动物作为预防和治疗用药,而通过食用途径进入人体,导致中毒,甚至死亡[3]。世界各国对抗生素药物残留均有严格的限量要求,欧盟已限制在供食用动物中的饲料中使用,中国也有相应的要求[4]。近年来,日本、韩国针对河豚鱼以药物残留为借口相继对中国河豚鱼实行贸易技术壁垒,限制和排斥中国河豚鱼出口。因此,为破解该类壁垒、促进出口,一种高灵敏度的测定河豚鱼和鳗鱼中大环内酯类抗生素的多残留方法是十分必要的。林可霉素等抗生素的吸收光谱多在紫外末端区,缺乏可用的特征紫外吸收区位。已见报道的文献中,主要分析方法有微生物法[5]、荧光光度法[6]、紫外分光光度法[7]、气相色谱[8]、薄层谱法[9]、高效液相色谱法[10~13]、毛细管电泳法(CE)[14]和液质联用技术LC-MSn法[15~17]法。在近期的文献报道中,测定大环内酯类残留,样品前处理大多采用缓冲溶液提取[18~27]合固相萃取技术分析技术,采用液相色谱-串联质谱方法检测。这种技术灵敏度高、选择性和特异性好,能够对低浓度的样品进行很好的定性确认,已经成为食品和环境中污染物定性、定量分析的重要手段。文献报道的测定大环内酯类分析方法多应用于食品和动物产品[15,20~27],未见到同时适用于河豚鱼、鳗鱼的相关检测研究。在参考以上文献的基础上,建立用Tris缓冲溶液提取河豚鱼和鳗鱼中8种大环内酯类抗生素残留,Oasis HLB固相萃取柱萃取、净化,罗红霉素为内标,LC-MS-MS检测河豚鱼和鳗鱼中8种大环内酯类抗生素的新方法。该方法经过4年的推广使用[26],提取操作简单、回收率稳定、灵敏度高、选择性好,未发现不良反应,林可霉素、红霉素、泰乐菌素、吉它霉素检出限达到2.0µg/kg,鳗鱼中的螺旋霉素、竹桃霉素、交沙霉素、替米考星检出限达到5.0µg/kg,低于国际上该类药物残留限量的检测要求。1 实验过程1.1 主要试剂水,符合GB/T 6682,一级。
甲醇、乙腈,色谱纯。
甲醇溶液(2+3)。
定容液:0.01 mol/L乙酸铵溶液+乙腈(17+3)。
tris溶液:依次溶解12.0 g三羟甲基氨基甲烷(tris)和7.35 g氯化钙(CaCl2·2H2O)于1000 mL水中,用盐酸调节pH值为9。标准物质:林可霉素(CAS 7179-49-9)、竹桃霉素(CAS 7060-74-4)、红霉素(CAS 59319-72-1)、替米考星(CAS 108050-54-0)、泰乐菌素(CAS 74610-55-2)、螺旋霉素(CAS 8025-81-8)、吉它霉素(CAS 1392-21-8)、交沙霉素(CAS 16846-24-5)和内标物质罗红霉素(CAS 80214-83-1),纯度≥95%。2.0 μg/mL标准工作溶液:依次准确称取每种标准物质适量,用甲醇溶解至浓度为1.0 mg/mL的标准储备溶液;将标准储备溶液用甲醇逐步稀释为2.0 μg/mL的标准工作溶液。1.0 μg/mL内标标准溶液:准确称取罗红霉素适量,用甲醇溶解为浓度1.0 mg/mL的内标储备溶液;将内标储备溶液用甲醇逐步稀释为1.0 μg/mL内标标准溶液。测定河豚鱼用基质标准混合工作溶液系列:分别吸取1.0 μL、2.0 μL、5.0 μL、25.0 μL浓度为2.0 μg/mL的标准工作溶液,依次加入到相应的试剂瓶中,再分别加入20.0 μL内标工作溶液,用河豚鱼样品空白提取液定容至1.0 mL。配成内标物浓度均为20 ng/mL,林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、螺旋霉素、吉它霉素和交沙霉素分别为2.0 ng/mL、4.0 ng/mL、10.0 ng/mL、50.0 ng/mL的四个浓度水平的测定河豚鱼用基质标准混合工作溶液系列。测定鳗鱼用基质标准混合工作溶液:分别吸取浓度为2.0 μg/mL的林可霉素、红霉素、泰乐菌素、吉它霉素标准工作溶液各1.0 μL、2.0 μL、5.0 μL、25.0 μL和螺旋霉素、竹桃霉素、交沙霉素、替米考星标准工作溶液各2.5 μL、5.0 μL、10.0 μL、25.0 μL,依次加入相应的试剂瓶中,再分别加入20.0 μL内标工作溶液,用鳗鱼样品空白提取液定容至1.0 mL。配成内标物浓度均为20 ng/mL,林可霉素、红霉素、泰乐菌素、吉它霉素分别为2.0 ng/mL、4.0 ng/mL、10.0 ng/mL、50.0 ng/mL,螺旋霉素、竹桃霉素、交沙霉素、替米考星分别为5.0 ng/mL、10.0 ng/mL、20.0 ng/mL 50.0 ng/mL的四个浓度水平的测定鳗鱼用基质标准混合工作溶液。Oasis HLB固相萃取柱:500 mg,6 mL。使用前,依次用10 mL甲醇和10 mL水活化,在抽真空前的各步骤中,都保持柱体湿润。1.2 主要仪器美国应用生物系统公司AB 3200 Q TRAP液相色谱-串联质谱仪(配有电喷雾离子源),固相萃取装置,氮气浓缩仪,天平,50 mL具塞聚丙烯离心管,离心力离心机(12 000 rpm以上),超声波清洗仪,pH计,振荡器。滤膜:0.2μm。1.3 实验条件1.3.1 液相色谱条件:色谱柱Atlantis C18,150 mm×2.1 mm,3 μm。流动相:A:乙腈;B:0.1%甲酸水溶液;流动相C:甲醇。流速:0.2 mL/min;进样量:20 µL;柱温:30℃。梯度洗脱条件见表1![]()
1.3.2 质谱条件条件:电喷雾离子源,正离子扫描,多反应监测方式,电喷雾电压5 500 V,雾化气压力0.24 Mpa,辅助气流速0.4 L/min,离子源温度550℃,碰撞室出口电压2.0 V。定性离子对、定量离子对、碰撞气能量和去簇电压,见表2。![]()
1.4
样品处理称取5 g试样,精确至0.01 g,置于50 mL离心管中,加入20.0 μL内标工作溶液和10.0 mL tris溶液,于振荡器上剧烈振荡10 min。以12 000 r/mi转速离心10 min,取上清液以小于1.0 mL/min的流速通过Oasis HLB固相萃取柱。再加入10.0 mL tris溶液,于振荡器上剧烈振荡10 min。以12 000 r/mi转速离心10 min,取上清液以小于1 mL/min的流速通过Oasis HLB固相萃取柱。待样液全部流出后,先后用10 mL水和10 mL甲醇溶液洗柱,弃去全部流出液,将固相萃取柱用真空泵抽干1 h。再用10 mL甲醇洗脱于15 mL氮吹管中,用氮气浓缩仪于50℃水浴中吹至近干,准确加入1.0 mL定容液,于超声波仪中超声波助溶残渣。用阴性样品,按上述步骤制备空白样品提取液。过0.2 μm滤膜后,供液相色谱-串联质谱仪测定。2 结果与讨论2.1方法的选择根据前人研究资料,重点研究了提取液、样液浓缩、缓冲溶液、固相萃取柱、洗脱剂用量对结果的影响。2.1.1提取溶液的选择根据相关文献[11,18,26]等资料,从动物组织中提取大环内酯类药物的主要提取溶液有磷酸盐缓冲溶液、0.3%偏磷酸-甲醇溶液、乙腈、Tris溶液和乙酸盐溶液,我们对此进行了对比实验,实验结果见表3。![]()
从表中数据可以看出,0.1mol/L磷酸盐缓冲溶液作为提取液时,8种大环内酯类抗生素的回收率结果不可用;0.3%偏磷酸-甲醇溶液(7+3)作为提取液时,除林克霉素的回收率小于70%、红霉素的回收率非常不稳定(30%~106%),其它6种大环内酯类抗生素的回收率大于70%;乙腈作为提取液时,除竹桃霉素、泰乐菌素的回收率大于70%外,其它6种大环内酯类抗生素的回收率均小于31.4%;0.1 mol/L乙酸盐溶液作为提取液时,螺旋霉素的回收率为154.0%、替米考星的回收率小于70%,其它6种大环内酯类抗生素的回收率均大于70%;Tris溶液作为提取液时,8种大环内酯类抗生素的回收率在78.4%~99.1%范围。所以本方法采用Tris溶液作为提取液。2.1.2 不同固相萃取柱对回收率的影响在前述选定条件下,对Varian C18、Oasis HLB(500 g)、Oasis HLB(200 g)、MCX和Bakerbond spe C18五种固相萃取柱的萃取效率进行了比较,结果见表4。结果表明Oasis HLB(500)固相萃取柱的效果最理想。因此,本方法选择Oasis HLB(500 g)固相萃取柱为净化柱。![]()
2.1.3内标的选择大环内酯测定的内标物选择主要有罗红霉素和林可霉素,我们对此进行了对比实验,实验结果见表5。![]()
从表中数据可以看出,当用林可霉素为内标时,只有替米考星、吉它霉素、交沙霉素3种大环内酯类抗生素中的回收率在94.2%~96.5%之间,其余的回收率在285%~2770%之间;当用罗红霉素为内标时,8种大环内酯类抗生素的回收率在76.5%~117.0%范围。所以本方法采用罗红霉素作为内标。2.2 质谱条件质谱仪器条件的优化用注射泵将含有罗红霉素内标的混合标准溶液以20 μL/min的速度直接注入离子源,用正离子检测方式对八种大环内酯类抗生素进行一级质谱分析(Q1扫描),得到质子化分子离子峰分别为407、688、734、869、916、843、772、828,再对质子化分子离子进行二级质谱分析(子离子扫描),得到碎片离子信息。然后再对去簇电压(DP)、碰撞气能量(CE)、电喷雾电压、雾化气和气帘气压力进行优化,使每种抗生素的分子离子与特征碎片离子产生的离子对强度达到最大,从中选择每种抗生素的监测离子对;将液相色谱和串联四极杆质谱仪联机,对离子源温度、辅助气流速进行优化,使每种抗生素的离子化效率达到最佳。2.3 液相色谱-串联质谱参考保留时间用系列基质混合标准工作溶液,分别进样。在仪器最佳工作条件下,以基质混合标准工作溶液浓度为横坐标,以峰面积为纵坐标,绘制标准工作曲线。用标准工作曲线对样品进行定量,样品溶液中八种大环内酯类抗生素的响应值均应在仪器测定的线性范围内。8种大环内酯类抗生素的参考保留时间分别为林可霉素6.96 min、竹桃霉素7.36 min、红霉素8.06 min、替米考星8.36 min、泰乐菌素8.48 min、螺旋霉素8.67 min、吉它霉素8.83 min、交沙霉素9.14 min2.4线性范围和测定低限配制浓度分别为2.0 ng/mL 、4.0 ng/mL、10.0 ng/mL、50.0 ng/mL的四个浓度水平的系列基质标准混合工作溶液,在选定的条件下进行测定,进样量为20 μL,用峰高对标准溶液中各被测组分的浓度做图。林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、螺旋霉素、吉它霉素、交沙霉素的绝对量在0.04 ng~1.0 ng范围内均呈线性关系,其线性方程和相关系数见表6。![]()
该方法操作条件下八种大环内酯类抗生素在添加水平2.0 µg/kg~50 µg/kg范围时,响应值在仪器线性范围之内,信噪比S/N大于5,林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、螺旋霉素、吉它霉素和交沙霉素的基质标准定量限LOQ(a)、样品定量限添加LOQ(b)和空白样品(c)检测多反应检测(MRM)图分别见下图中的图1、图2、图3、图4、图5、图6、图7、图8。
![]()
图1 林可霉素的基质标准定量限LOQ(a)、样品定量限
添加(b)和空白样品(c)检测多反应检测(MRM)图
![]()
图2 竹桃霉素的基质标准定量限LOQ(a)、样品定量限
添加(b)和空白样品(c)检测多反应检测(MRM)图
![]()
图3 红霉素的基质标准定量限LOQ(a)、样品定量限
添加(b)和空白样品(c)检测多反应检测(MRM)图
![]()
图4 替米考星的基质标准定量限LOQ(a)、样品定量限
添加(b)和空白样品(c)检测多反应检测(MRM)图
![]()
图5 泰乐菌素的基质标准定量限LOQ(a)、样品定量限
添加LOQ(b)和空白样品(c)检测多反应检测(MRM)图
![]()
图6 螺旋霉素的基质标准定量限LOQ(a)、样品定量限
添加LOQ(b)和空白样品(c)检测多反应检测(MRM)图
![]()
图7 吉它霉素的基质标准定量限LOQ(a)、样品定量限
添加LOQ(b)和空白样品(c)检测多反应检测(MRM)图
![]()
图8 交沙霉素的基质标准定量限LOQ(a)、样品定量限
添加LOQ(b)和空白样品(c)检测多反应检测(MRM)图
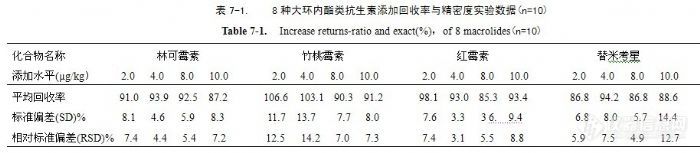
Fig A. 1 Chromatographs for multiple reaction monitoring (MRM) of nine macrolides antibiotics standards根据最终样液所代表的试样量、定容体积、进样量和进行测定时所受的干扰情况,确定本方法测定河豚鱼中的林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、螺旋霉素、吉它霉素和交沙霉素均为2.0 μg/kg;鳗鱼中的林可霉素、红霉素、泰乐菌素、吉它霉素均为2.0 µg/kg,螺旋霉素、竹桃霉素、交沙霉素、替米考星均为5.0 µg/kg。2.5方法的回收率和精密度用不含8种大环内酯类抗生素的河豚鱼样品进行添加回收和精密度实验,样品中添加2.0 µg/kg、4.0 µg/kg、8.0 µg/kg、10.0 µg/kg不同浓度标准后,摇匀,使标准样品充分吸收,然后按本方法进行提取、净化、测定,其回收率和精密度见表7。![]()
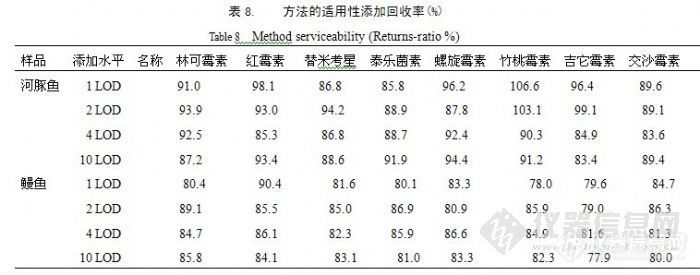
![]() 从表中的回收率及精密度数据可以看出,本方法回收率数据全部在75.4%~%124.0之间,室内四个水平相对标准偏差均在12.46%以内,说明方法的回收率和精密度良好。2.6 方法的适用性我们采用本方法,对河豚鱼和鳗鱼在1 LOD、2 LOD、4 LOD、10 LOD四个添加水平的八种大环内酯抗生素进行添加回收率实验。河豚鱼八种大环内酯类抗生素的1 LOD为2.0µg/kg、2 LOD为4.0µg/kg、4 LOD为8.0µg/kg、10 LOD为20.0µg/kg。鳗鱼中,1 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素2.0 µg/kg、螺旋霉素、竹桃霉素、交沙霉素、替米考星5.0µg/kg;2 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素4.0 µg/kg,螺旋霉素、竹桃霉素、交沙霉素、替米考星10.0µg/kg;4 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素8.0 µg/kg,螺旋霉素、竹桃霉素、交沙霉素、替米考星20.0 µg/kg;10 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素20.0 µg/kg,螺旋霉素、竹桃霉素、交沙霉素、替米考星50.0µg/kg。方法的适用性添加回收率结果见表8。
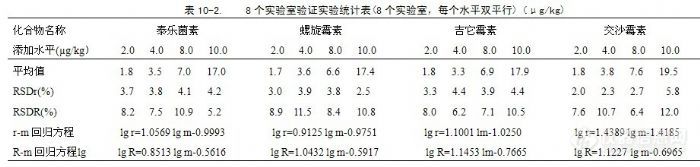
从表中的回收率及精密度数据可以看出,本方法回收率数据全部在75.4%~%124.0之间,室内四个水平相对标准偏差均在12.46%以内,说明方法的回收率和精密度良好。2.6 方法的适用性我们采用本方法,对河豚鱼和鳗鱼在1 LOD、2 LOD、4 LOD、10 LOD四个添加水平的八种大环内酯抗生素进行添加回收率实验。河豚鱼八种大环内酯类抗生素的1 LOD为2.0µg/kg、2 LOD为4.0µg/kg、4 LOD为8.0µg/kg、10 LOD为20.0µg/kg。鳗鱼中,1 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素2.0 µg/kg、螺旋霉素、竹桃霉素、交沙霉素、替米考星5.0µg/kg;2 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素4.0 µg/kg,螺旋霉素、竹桃霉素、交沙霉素、替米考星10.0µg/kg;4 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素8.0 µg/kg,螺旋霉素、竹桃霉素、交沙霉素、替米考星20.0 µg/kg;10 LOD为林可霉素、红霉素、泰乐菌素、吉它霉素20.0 µg/kg,螺旋霉素、竹桃霉素、交沙霉素、替米考星50.0µg/kg。方法的适用性添加回收率结果见表8。![]() 在这四个添加水平,八种大环内酯类抗生素出峰区域未见干扰峰,河豚鱼样品的回收率在75.4%~%124.0之间、鳗鱼样品的回收率在70.7%~106.0%之间,所做空白样品实验也表明,对于河豚鱼和鳗鱼样品,本方法的适用性很好。2.7方法的实验室间验证结果本方法经8个实验室进行重复性和再现性验证。用不含八种大环内酯类抗生素的河豚鱼样品分别做2.0 µg/kg、4.0 µg/kg、8.0 µg/kg、20.0 µg/kg四个水平的添加回收率实验,验证结果见表10。
在这四个添加水平,八种大环内酯类抗生素出峰区域未见干扰峰,河豚鱼样品的回收率在75.4%~%124.0之间、鳗鱼样品的回收率在70.7%~106.0%之间,所做空白样品实验也表明,对于河豚鱼和鳗鱼样品,本方法的适用性很好。2.7方法的实验室间验证结果本方法经8个实验室进行重复性和再现性验证。用不含八种大环内酯类抗生素的河豚鱼样品分别做2.0 µg/kg、4.0 µg/kg、8.0 µg/kg、20.0 µg/kg四个水平的添加回收率实验,验证结果见表10。![]()
![]() 按照国家标准GB/T 6379《测试方法的精密度 通过实验室间试验确定标准测试方法的重复性和再现性》进行精密度数据统计,全部实验数据经格拉布斯(Grubbs)法、科克伦(Cochran)法、狄克逊(Dixon)法检验未发现异常值。八种大环内酯类抗生素重复性相对标准偏差(RSDr)在1.34%~5.79%之间,再现性相对标准偏差(RSDR)在6.20%~15.27%之间,均符合国际AOAC标准分析方法对国际协同研究实验室内与实验室间重复性相对标准偏差和再现性相对标准偏差之要求。3 结论HPLC-MS-MS同时测定河豚鱼和鳗鱼中林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、克林霉素、螺旋霉素、吉它霉素、交沙霉素等8中抗生素残留量的检测方法,操作简单、回收率稳定、灵敏度高、选择性好、定量同时可以定性,检出限均符合世界各国对该类药物残留的检测要求。
按照国家标准GB/T 6379《测试方法的精密度 通过实验室间试验确定标准测试方法的重复性和再现性》进行精密度数据统计,全部实验数据经格拉布斯(Grubbs)法、科克伦(Cochran)法、狄克逊(Dixon)法检验未发现异常值。八种大环内酯类抗生素重复性相对标准偏差(RSDr)在1.34%~5.79%之间,再现性相对标准偏差(RSDR)在6.20%~15.27%之间,均符合国际AOAC标准分析方法对国际协同研究实验室内与实验室间重复性相对标准偏差和再现性相对标准偏差之要求。3 结论HPLC-MS-MS同时测定河豚鱼和鳗鱼中林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、克林霉素、螺旋霉素、吉它霉素、交沙霉素等8中抗生素残留量的检测方法,操作简单、回收率稳定、灵敏度高、选择性好、定量同时可以定性,检出限均符合世界各国对该类药物残留的检测要求。