最近版里原创热风呼呼的刮~~于是我也特来跟风积极参与!近来一直在做包涵体的复性与纯化,就特来与大家分享,希望大家多多支持、指点 1.包涵体的分离纯化
1.包涵体的分离纯化 蛋白质的纯化是基因工程下游的关键内容,以包涵体形式表达的重组蛋白质的纯化研究一直是重组基因工程药物研究中的热点和难点。重组蛋白在宿主系统中高水平表达时,无论是用原核表达体系或酵母表达体系甚至高等真核表达体系,都可形成包涵体。蛋白表达后的分离纯化对蛋白的规模化生产也是至关重要的,所以本实验通过采用稀释复性、透析复性、离子交换层析、凝胶过滤层析等实验方法,研究探讨对分离纯化以及蛋白复性的最佳方法和条件。
1.2.1包涵体的复性 重组蛋白质在分离纯化的过程中, 必须维持一定的浓度和生物活性形式, 以及防止被降解。从包涵体中获得有生物活性的蛋白,需要寻找一种简单而有效的复性方法。在小规模的蛋白复性研究及其进一步的纯化中,稀释复性是最常用的方法。但是稀释复性在商业规模生产中具有一定的缺陷,如需要较大体积的复性液,以及需要附加的浓缩步骤。许多其他方法也已发展起来,例如:透析、渗透、低分子量辅助物添加复性、离子和无离子表面活性剂辅助复性、聚乙烯乙二醇辅助复性等方法。
在折叠反应中,从伸展态到中间体的速度是非常快的,只需要几毫秒,但从中间体转变为天然态的过程比较缓慢,是一个限速过程。聚集过程与复性过程相互竞争,故而应尽量避免聚集体的产生。一般认为,蛋白质在复性过程中涉及两种疏水作用,一是分子内的疏水相互作用,可促进蛋白质正确折叠;一是部分折叠的肽链分子间的疏水相互作用,在复性过程中,部分折叠的中间体的疏水簇外露,分子间的疏水相互作用会导致蛋白质聚集。蛋白质的立体结构虽然由其氨基酸的顺序决定,然而伸展肤链折叠为天然活性结构的过程还受到周围环境的影响,如温度、pH值、离子强度、复性时间等因素的影响。
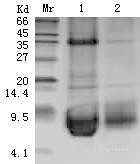
1.2.2包涵体离子交换层析纯化 为了获得高纯度的活性蛋白, 需要对复性的蛋白质进行进一步纯化。根据分离目标蛋白的特点(如P I、疏水性、氨基酸组成, 分子量大小、表面电荷的分布状况) , 然后确定分离方法, 从而正确选择最有效的分离介质,本实验采用SP Sepharose F.F 阳离子交换层析分离纯化重组蛋白
离子交换层析是以蛋白质分子净电荷和表面电荷分布为分离基础的。具体说就是利用蛋白质带电性的差异,在离子吸附剂上静电吸附能力不同,用不同的pH 离子强度洗脱液洗脱,从而使蛋白质分离的柱层析方法。离子交换又分为阴离子交换和阳离子交换。离子交换剂又有强弱之分,强的离子交换剂在整个pH 范围内都是离子化的,而弱的离子交换剂通常仅在pH6~9 之间是离子化状态,因而后者对所适用的pH 范围又有了进一步的限制。
在洗脱方式上,阳离子交换主要是改变pH ,它主要应用于等电点大于5 的蛋白质。20 种氨基酸中,大部分带正电或负电,这是IEC 应用范围广的原因。离子交换层析处理量大,附载系数高,一步缩小样品体积很多。离子交换层析去除杂质能力强,如对热原质,核酸、及电荷性有差别的蛋白均可去除。它还有一个特点,利用蛋白质在不同pH 和盐浓度下带电性的不同,通过不同条件下应用同种类型或不同类型介质,分步使目标蛋白质达到提纯目的,这是除亲和柱层析外,别的柱层析达不到的分离能力。离子交换层析原则上可放在纯化工艺的任何一步,它属吸附型层析,单步损失也较大。