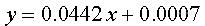9.用二苯碳酰二肼分光光度法测定水中六价铬,校准曲线回归方程为y=0.1252x+0.002(y:吸光度; x: 六价铬的质量,ug)。若取5mL水样进行测定,测定吸光度为0.088, 空白测定吸光度为0.008。求水中六价铬的含量?
解:水样的校正吸光度为0.088-0.008=0.08
代入校准曲线回归方程,x=(0.08-0.002)/0.1252=0.623 ug
六价铬的含量(mg/L)=0.623/5=0.125
10:用分光光度法测定一水样中总铬时,所得标准曲线的数据为:
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
解:最小二乘法
水样测定的吸光值为0.095。在同一水样中加4.00ml铬标准溶液(1.0ug/mL)的量测定加标回收率。其吸光度为0.267。
试计算加标回收率(不考虑加标体积的影响)。
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
校正A 0.000 0.010 0.020 0.043 0.090 0.183 0.268 0.351 0.441
解:
最小二乘法
技能题
9.用二苯碳酰二肼分光光度法测定水中六价铬,校准曲线回归方程为y=0.1252x+0.002(y:吸光度; x: 六价铬的质量,ug)。若取5mL水样进行测定,测定吸光度为0.088, 空白测定吸光度为0.008。求水中六价铬的含量?
解:水样的校正吸光度为0.088-0.008=0.08
代入校准曲线回归方程,x=(0.08-0.002)/0.1252=0.623 ug
六价铬的含量(mg/L)=0.623/5=0.125
10:用分光光度法测定一水样中总铬时,所得标准曲线的数据为:
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
解:最小二乘法
水样测定的吸光值为0.095。在同一水样中加4.00ml铬标准溶液(1.0ug/mL)的量测定加标回收率。其吸光度为0.267。
试计算加标回收率(不考虑加标体积的影响)。
铬μg 0.00 0.20 0.50 1.00 2.00 4.00 6.00 8.00 10.00
A 0.007 0.017 0.027 0.050 0.097 0.190 0.275 0.358 0.448
校正A 0.000 0.010 0.020 0.043 0.090 0.183 0.268 0.351 0.441
解:
最小二乘法
![]()