4 质子条件式
物料平衡 (Material (Mass) Balance):
各物种的平衡浓度之和等于其分析浓度。
电荷平衡 (Charge Balance):
溶液中正离子所带正电荷的总数等于负离子所带负电荷的总数(电中性原则)。
质子平衡 (Proton Balance):
溶液中酸失去质子数目等于碱得到质子数目。
物料平衡
各物种的平衡浓度之和等于其分析浓度。
质量平衡方程(MBE)
例:2X10
-3 mol/L ZnCl2 和 0.2 mol/L NH3
[Cl-] = 4X10
-3 mol/L
[Zn2+] +[Zn(NH3)
2+] +[Zn(NH3)2
2+] +[Zn(NH3)3
2+] +[Zn(NH3)4
2+] = 2X10
-3 mol/L
[NH3] +[Zn(NH3)
2+] +2[Zn(NH3)2
2+] +3[Zn(NH3)3
2+] +4[Zn(NH3)4
2+] = 0.2 mol/L
电荷平衡
溶液中正离子所带正电荷的总数等于负离子所带负电荷的总数(电中性原则)。
电荷平衡方程(CBE)
Na2C2O4水溶液
[Na
+] + [H
+] = [OH
-] + [HC2O4
-] + 2[C2O4
2-]
质子平衡
溶液中酸失去质子数目等于碱得到质子数目。
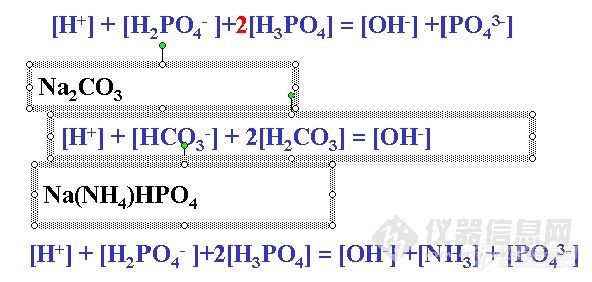
质子条件式(PBE)
(1) 先选零水准 (大量存在,参与质子转移的物质), 一般选取投料组分及H2O
(2) 将零水准得质子产物写在等式一边,失质子产物写在等式另一边
(3) 浓度项前乘上得失质子数
例:Na2HPO4水溶液
零水准:H2O、HPO4
2-![]()

 05.rar
05.rar