研究多结构域蛋白阶段性去折叠
很多生物大分子的功能与其构象和构象动力学密切相关,如蛋白质的生物功能需要其正确折叠成自然形态。错误折叠或者未折叠的蛋白会(部分)失活或者产生毒性,如错误折叠的蛋白与神经退行性疾病有关。
研究蛋白如何正确折叠并改变构象以实现生物功能对理解其机制与疾病发生至关重要。单分子力谱(SMFS)是研究这些分子现象的理想工具,因为其具有独特的分离个体生物分子和实时观察构象变化及去折叠过程的功能。
由于SMFS具有高敏感度和施加机械力的能力,可以直接操纵单个蛋白并通过测量其长度变化(亚nm级)观察构象改变。接下来我们使用LUMICKS开发的高分辨率光镊-荧光显微镜C-Trap演示了对钙调蛋白(CaM)的折叠过程的研究。
![]()
![]()
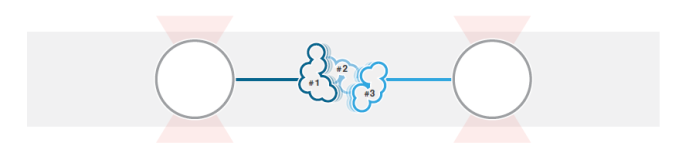
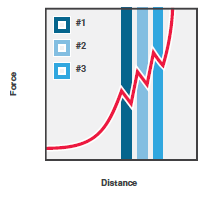
1 多结构域蛋白的去折叠实验图解。具有3个结构域的蛋白通过DNA连接至两个被光所捕获的微球。2 通过改变光阱之间的距离可以对蛋白施力并检测断裂的发生。
使用层流微流控和自动装载功能,N-端和C-端连接有DNA的单个CaM蛋白可被两个微球捕获(图1)。
![]()
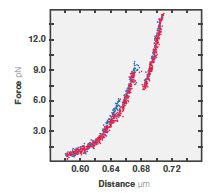
3 10 mM Ca2+浓度下CaM的力-拉伸距离(蓝色)和力-收缩距离(红色)。拉伸与收缩的速度为100 nm/s。微球直径为1.0 μm,光阱的刚度为0.284 pN/nm。
![]()
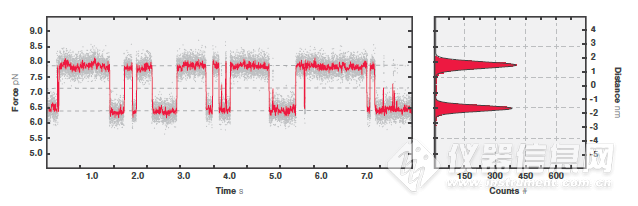
4 10 mM Ca2+浓度下CaM的多个状态下的动态平衡。图为50 kHz(灰色)和200 kHz(红色)下记录的数据。在右侧直方图中可以看到两个清晰的峰即表现为蛋白最常处于的两个状态。
第一个实验,在10 mM Ca2+条件下对CaM的机械拉伸与收缩行为进行了记录。首先对100 nm/s的速度下的拉伸与收缩的相关数据进行了记录(图3)。随着施加的力增加,可观察到两个去折叠的阶段,表现为力的突然下降,与两个螺旋-环-螺旋结构域的去折叠相符合。由此可以得出结论,基于C-Trap设备的力和距离的高分辨率(100 Hz时误差在0.2 pN以下和0.5nm以下),去折叠的发生可以用力谱的力-距离曲线来确定。这种测量非常适合用于比较正常蛋白与发生了改变或损伤的蛋白的折叠的相关数据。
接下来研究光阱位置固定时CaM的折叠、去折叠的动态平衡,对蛋白长度的变化进行测量并确定中间态的转变(图4)。对CaM分子施加7.5 pN的力,可以观察到三种状态之间的波动,反映了螺旋-环-螺旋亚结构域的折叠和去折叠,波动的数据图像与之前的研究1,2相符(图4)。仪器所获得的稳定的高质量数据为蛋白的折叠和去折叠之间的动态转变的检测提供了大量有效的信息。通过这种方法可以对不同状态的驻留时间和转变动力学进行测量。这些信息使得我们对特定蛋白的折叠、去折叠过程产生进一步的了解。
对折叠和去折叠的动力学以及构象改变的研究表现了一种突破性的生物学和生物物理学研究方法。使用C-Trap光镊-荧光技术可以观察到折叠和去折叠现象还有动态平衡,使得科研人员可以研究去折叠的中间态并获得蛋白的结构与功能信息。对蛋白折叠和构象的进一步研究仰仗于C-Trap的高敏感度和多通道荧光单分子FRET功能,通过检测FRET效率信号与力的波动的变化来进一步检测蛋白构象,可以得到蛋白的机械性质与结构之间的关系。