6.怎样理解金属“电位”的概念与术语?
上面的表 4-.1 给出了主要金属的电化学电位序,可以看出,不同金属的“电位”也不同。 “电位”是涉及金属腐蚀的重要概念,同时又有非常广泛的使用意义。
现在要解释“电位”的含义,一方面非常必要,另一方面,还需要费一些周转方能说的明白些。
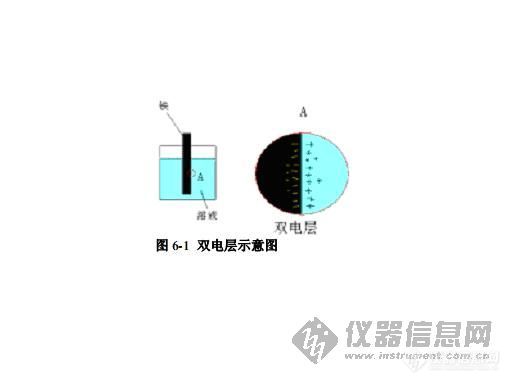
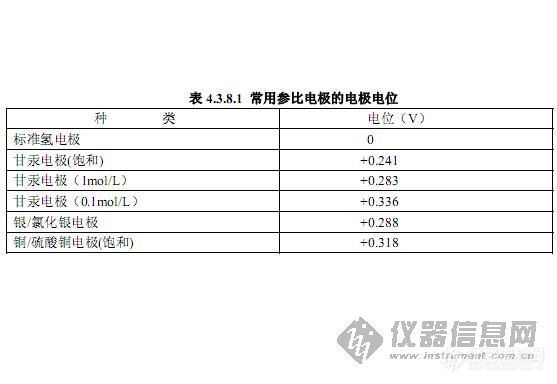
我们先看图 6-1,铁浸在溶液中,铁的表面存在一个“双电层” ,这个“双电层”的正极是溶液中紧靠铁表面带正电的铁离子,而负极是留在铁表面上的电子(带负电) ,这个“双电层”的电位差就定义为在此条件下铁“绝对电位” 。很可惜,科学发展到现在,这个“绝对电位”还是无法测量的。于是,人们设想出测量其“相对电位”的办法。那就是把氢与氢离子所构成的双电层的“绝对电位”定义为零值(实际值并不知道,但在标准条件下,这个值是固定不变的) ,然后用氢的“绝对电位”与铁(或其他金属)的“绝对电位”做“比较” ,凡高于氢的“绝对电位”者(大于零)为正值,相反为负值。这样,就像人们先定义一把尺的长度(如 1 米) ,在用这把尺子量度那些未知的长度一样。以标准氢电极作为标准,来测量那些未知“绝对电位”值,所测得的是一个相对比较值,但它已经能够达到区分不同金属“双电层”表征的目的。此相对比较值(表 6-1)就是通常所说的某金属的电化学电位,简称电位。
![]()
实际中,氢电极是难以在现场使用的,于是就出现许多类型的“参比电极” (表6-1),以便用于各种场合下测量不同金属的电位值。常见的有甘汞电极、氯化银电极、饱和硫酸铜电极、金属铂电极等。在标准条件下,这些电极都有固定的电位值(与氢电极比较) ,可以用这些参比电极进行测量,并可换算成氢电极比较电位。通常不换算时,必须注明所用参比电极的种类。
![]()
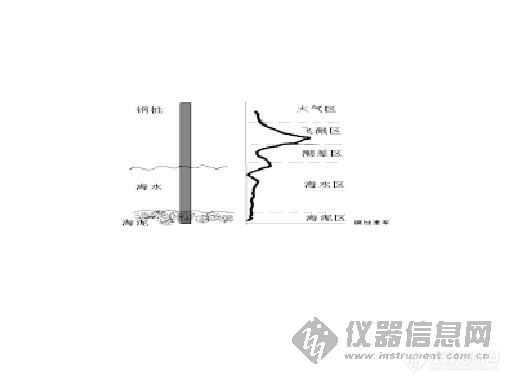
钢铁处在不同的介质中,其电位值也不一样。一般说来,电位负值越高,表明其腐蚀活性越大。因此,可以用测量电位的方法,
7. 气候与钢铁腐蚀的关系如何?
图7-1是我国按气候划分的腐蚀影响程度的区分图,颜色深的部分表示是重腐蚀区(高温高湿),颜色浅的部分表示轻腐蚀区。可以看出,我国东南部大多处在重腐蚀区内。 就温度与腐蚀的关系而言, 有资料表明,温度每提高 10℃,钢铁的腐蚀就增加 1 倍。预测金属(包括钢铁)的腐蚀情况。 而湿度与腐蚀的关系更为密切。图 7-2 表明了钢铁腐蚀与相对湿度(RH)的关系,可以看出,低相对湿度(如 RH≤60%) ,钢铁不腐蚀或腐蚀速度很低,而 RH在 90—98%范围内,钢铁腐蚀速度最高。大气污染严重区的区域,也往往是腐蚀的“重灾区” 。二氧化硫、氮氧化物、粉尘、酸雨等都能够大大加速钢铁和其它金属的腐蚀。