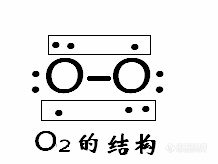
![]()
元素用途:
氧被大量用于熔炼、精炼、焊接、切割和表面处理等冶金过程中;液体氧是一种制冷剂,也是高能燃料氧化剂。它和锯屑、煤粉的混合物叫液氧炸药,是一种比较好的爆炸材料,氧与水蒸
气相混,可用来代替空气吹入煤气气化炉内,能得到较高热值的煤气。液体氧也可作火箭推进剂;氧气是许多生物过程的基本成分,因此氧也就成了担负空间任何任务是需要大量装载的必需品之一。医疗上用氧气疗法,医治肺炎、煤气中毒等缺氧症。石料和玻璃产品的开采、生产和创造均需要大量的氧。
元素辅助资料:
氧气是空气的主要组成部分。许多氧化合物,例如硝酸钾、氧化汞等在加热后都会放出氧气。氧是所有元素在地壳中含量最大的。这些都说明,氧气很早就可能被人们取得。但由于氧气是在平常状态下以气体状况存在,和可接触到的、可见的固体、液体不同,使人们单纯用直觉观察,是不能认清它的。
从16世纪开始,在西欧,不少研究者们对加热含氧化合物获得的气体,对空气在物质燃烧和动物呼吸中所起的作用,进行了初期的科学的化学实验,从而才发现了氧气。也就是在人们正确认识到燃烧现象,发现氧气后,才彻底推翻了燃素说。
拉瓦锡通过实验确定了空气中促进物质燃烧的气体物质是一种元素,称它为oxygène(法文,英文为oxygen)。这一词来自希腊文oxys(酸)和gene(产、生、源),即“酸之源”的意思。空气中的另一部分称为azote,来自希腊文a(没有)和zoe(生命),是“不能维持生命”的意思。
“oxygen”,我们今天称为氧。它的拉丁名称是oxygenium,元素符号为O。