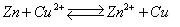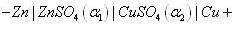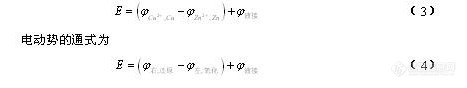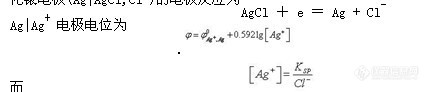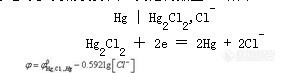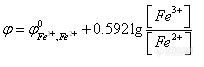电化学分析法(9)—金属基电极1.2.5 电极的类型
12.5.1 金属基电极
金属基电极是最早使用的一类电极,其共同特点是电极电位的产生与氧化还原反应即与电子转移有关。因有金属参加,故称金属基电极,一般有以下三类:
(1)第一类电极(金属-金属离子电极)
将金属插入该金属离子溶液中构成的电极。电极结构为M|Mn+,如银丝插在AgNO3溶液中,其电极反应为
![]()
由上可知,电极电位随溶液中待测离子活度(或浓度)的变化而变化,可用以指示溶液中待测离子的浓度,这类电极称为指示电极,第一类电极常作为指示电极。
(2)第二类电极(金属-金属难溶盐电极)
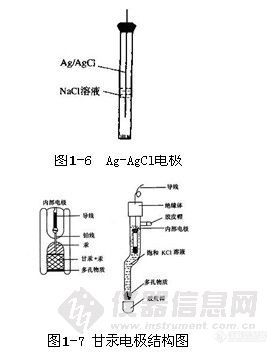
第二类电极是由金属、该金属难溶盐与该难溶盐的阴离子构成的电极,这类电极有两个界面。例如银-氯化银电极(图1-6)、甘汞电极等。银-氯化银电极(Ag|AgCl,Cl-)的电极反应为
![]()
这类电极的电极电位随阴离子活度的增加而减小,能用来测定不直接参与电子转移的难溶盐的阴离子活度,但是由于选择性差等问题,一般不作指示电极。若溶液中存在能与该金属阳离子生成难溶盐的其他阴离子,将产生干扰,此类电极常用作参比电极。参比电极是指在一定温度下,电极电位值在测定过程中基本恒定不变,不受试液中待测离子浓度变化而改变的电极。参比电极在特定温度下电位必须稳定、重现性好且容易制备。甘汞电极和 Ag-AgCI电极是常用的参比电极。
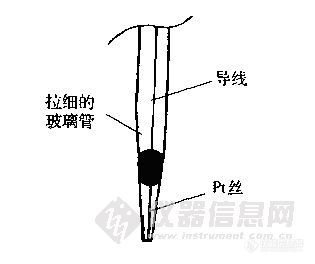
甘汞电极 由金属池、Hg2Cl2(甘汞)和 KCl溶液组成的电极。由两个玻璃套管(电极管)组成,内电极管中封接一根铂丝,铂丝插入纯汞中(厚度为0.5~1cm),下置一层甘汞(Hg2Cl2)和汞的糊状物,放入外玻璃管中,外电极管中充入 KCl溶液作为盐桥,内外电极管下端都用多孔纤维或烧结陶瓷芯或玻璃砂芯等多孔物质封口,其结构如图1-7所示。
![]()
在一定温度下,当Cl-的活度(或浓度)一定时,其电极电位为定值。甘汞电极的稳定性和再现性都较好,是最常用的参比电极
![]()
(3)零类电极(惰性金属电极)
用惰性材料如铂、金或石墨等做成片状或棒状,浸入同一元素的氧化还原电对的溶液中构成的电极。例如,Pt | Fe3+,Fe2+ 电极,电极反应为
Fe3+ + e = Fe2+
电极电位为
![]()
电极电位与两种离子的性质及活度的比率有关,惰性金属或石墨本身并不参加电极反应,只是作为氧化还原反应交换电子的场所,协助电子的转移