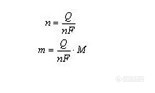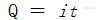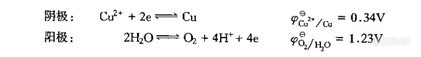电化学分析法(17)—恒电流电解2.2.2 恒电流电解
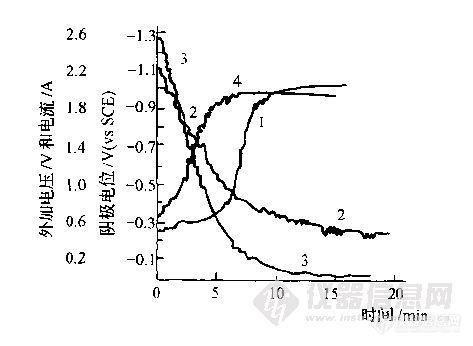
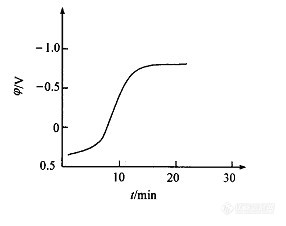
在电流恒定条件下进行电解,称为恒电流电解法。电解CuSO4溶液时,阴极电位随时间的变化如图2-4所示。电解开始后阴极表面附近Cu2+浓度不断降低,阴极电位逐渐变负。经过一定时间后,由于浓度较低,电位改变的速率比较缓慢,曲线。出现一段较相对平坦部分。与此同时,电解电流也不断降低。
![]()
图2-4 阴极电位随时间的变化
为了保持电解电流恒定,必须增大外加电压,使阴极电位更负一些,使 Cu2+以足够快的速度迁移到阴极表面发生电极反应以维持电解,保持电流的恒定。外加电压越大,阴极电位越低。
当阴极电位负到H+的还原电位时,氢和铜同时在阴极上还原。由于大量H+在阴极上还原,因而稳定了阴极电位。此时,电解电流也基本是恒定的,而Cu2+继续在阴极还原析出,直至电解完全。
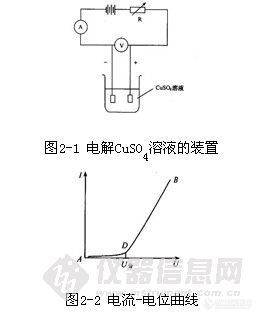
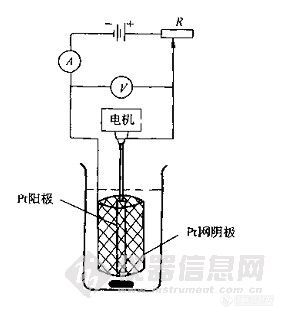
恒电流电解时,电极一般由网状铂阴极和螺旋状铂阳极组成,这种电极表面积大,即使使用大电流电解仍可保持较小的电流密度,析出的金属致密光滑。电解时,将阳极插在阴极中间,并转动阳极起搅拌作用。如图2-5。
![]()
图2-5 恒电流电解分析装置示意图
恒电流电解时,一般将外加电压一次加到足够大的数值,因此电解效率高,分析速度快,但选择性不高,只适用于简单样品分析。
在酸性溶液中,恒电流电解法只能用于测定金属置换序中氢后面的金属,氢前面的金属不能在此条件下析出。
恒电流电解分析时的电极反应速率比控制电位电解分析的快,但选择性差,往往第一种金属离子还未完全沉积时,由于电位变化,第二种金属离子也会在电极上析出而产生干扰。
为了防止干扰,可使用阳极或阴极去极剂刘(也称电位缓冲剂)以维持电极电位不变,防止发生干扰的氧化还原反应.例如在Cu2+和Pb2+混合溶液中分离沉积Cu时,在试液中加入NO-3能防止Pb的沉积,NO-3在阴极上还原生成NH+4
NO-3 十10H+ 十 8e = NH+4 十3H2O
由于NO-3还原电位比Pb2+更正,因此,该反应发生在Pb2+还原之前.当Cu2+电解完成时.因NO-3的还原防止了Pb的沉积在本例中.铅能在阳极上沉积为PbO2
Pb2+ 十2H2O= PbO2 + 4H+ 十2e
称量每支电极上的纯沉积物的质量,可以求得金属的含量。