摘 要 建立了同时测定饲料中8种苯并咪唑类药物(噻苯咪唑、丙硫咪唑、硫苯咪唑、苯硫氧咪唑、氟苯咪唑、甲苯咪唑、丙氧苯唑和三氯苯唑)的
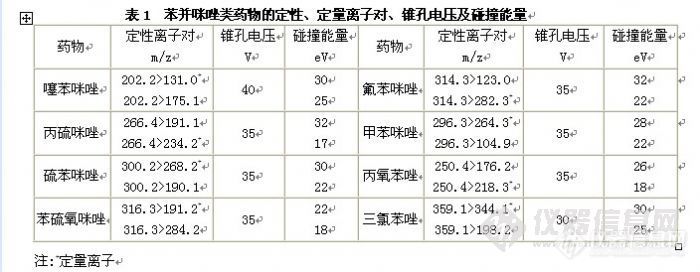
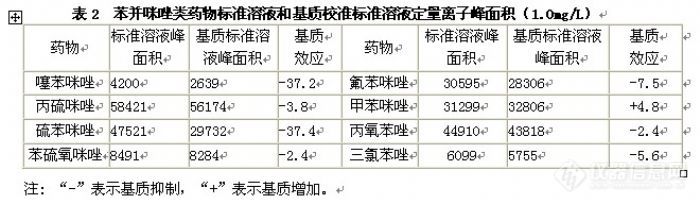
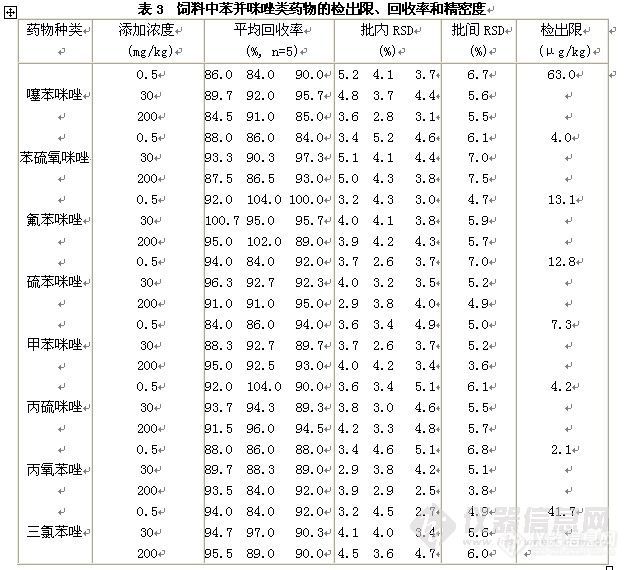
液相色谱串联质谱分析方法。饲料样品直接用酸化乙腈提取,提取液用甲酸溶液稀释后直接进行分析。分析时采用XBridgeTM C18色谱柱,以甲酸溶液-乙腈体系进行梯度洗脱,MRM方式测定,基质外标法定量。苯并咪唑类药物在0.02~10 mg L-1浓度范围内呈良好的线性,线性相关系数均大于0.990,苯并咪唑类药物在饲料样品中最低检测限为2.1~63.0μg/kg。饲料中苯并咪唑类药物在0.50~200 mg/L范围内的回收率为84.0%~104%之间,相对标准偏差(RSD)均小于10%。