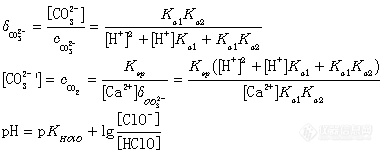楼主的这个问题其实是一个比较复杂的多重平衡的问题,不能简单地从两个平衡常数来判断是或否。正如,谁都知道:硫酸钡是酸碱不溶(王水也不溶),但定性实验中,却可以用饱和碳酸钠来加热处理几次,就可以将硫酸钡转化为碳酸钡,然后用盐酸、醋酸来溶解。这是平衡移动的原理,也是把“不可为”变成可为的案例。
本例中,会不会生成碳酸钙沉淀,这需要定量计算,沉淀与否的判断依据是溶度积规则,当酸碱平衡时,因为CO
2为少量,次氯酸钙为大量,反应中要生成少量的HClO,剩余大量的ClO
-,故本例中的PH值主要由次氯酸-次氯酸根缓冲溶液体系控制,如果溶液中的碳酸根浓度与钙离子浓度大于Ksp,则沉淀,反之则否。显然,这里的少量CO
2是需要有个范围的,不然无法计算和判断。
本例的复杂性在于,沉淀与否不但决定于CO
2和ClO
-的原浓度,还决定于反应后溶液的PH值,而PH值的计算又与溶液的两个弱酸体系的相互转化与平衡分布有关,与沉淀溶解平衡的酸效应有关。下面是一种近似计算和判断:
为了计算的方便,先用0.10M NaClO + 0.001M CO
2 混合液来讨论,最终求得CO
32-平衡浓度后,再换为0.050MCa(ClO)
2,再用Ksp来判断沉淀与否。
(1)反应体系中酸碱主要存在形式的判断(暂时不考虑沉淀与否)
假定CO
2只生成HCO
3-,对于0.0010M的CO
2,PH=8.3
次氯酸根与CO
2反应后,生成了0.0010M的 HClO,同时剩下0.0990M的ClO
-,构成了缓冲溶液,作近似计算,PH=9.53
比较两个PH值知(8.3与9.53),HCO
3-还应该有部分转化成CO
32-,当然,整个溶液的PH值会随之降低一点。
(2)计算方法
已设CO
2为0.0010M,它的量为次氯酸钠的1/100,后续再部分转化为CO
32-后,对整个溶液的PH影响不大,假定仍为PH=9.53。
这样,我们可以根据指定的PH值来计算该条件下,对于总浓度为0.0010M CO
2,平衡时应该含多大浓度的CO
32-.
用分布分数计算得
[CO
32-]=0.0010×δ(CO
32-)=1.3×10
-4M
将次氯酸钠换为0.050M的次氯酸钙(次氯酸根浓度仍为0.10M),含0.050M钙离子,碳酸钙的Ksp=2.9×10
-9,
显然,0.050×0.00013>>Ksp
可见,会有沉淀的。
(如果生成的HCO
3-部分转化为CO
32-时,也考虑ClO
-部分转化为HClO,精确计算PH值的话,缓冲溶液PH的计算会复杂一点,但因是缓冲溶液,且碳酸氢根的浓度本来就很小,PH降低不大,因此,这里的PH值仍用9.53,这是合理的)
(3)更少量CO
2的计算
仍假定含0.10MClO
-,如果CO
2浓度更低,它对次氯酸钙原溶液的PH值已几乎没影响了,则可以计算出该次氯酸钙的PH=10.4(按一元弱碱计算,质子理论中的弱碱),在这个PH条件下,碳酸根的分布分数值为0.54,在碳酸盐体系中已占“半壁江山”了,CO
2不沉淀的浓度阈值是:1.07×10
-7M
看来资料上的结论是正确的。
附:有关的计算公式
![]()