
金刚烷胺是最早用于抑制流感病毒的抗病毒药,美国于亚洲感冒流行的1966年批准其作为预防药。并于1976年在预防药的基础上确认其为治疗药。该药对成年患者的疗效及安全性已得到广泛认同。但治疗剂量与产生副作用的剂量很接近,对高龄者及有慢性心肺疾病或肾脏疾病者的剂量和给药计划很难确定,因此尚未在临床上推广应用。在日本,金刚烷胺一直作为帕金森病的治疗药,直到1998年才被批准用于流感病毒A型感染性疾病的治疗。也可用于预防或治疗亚洲甲-Ⅱ型流感病毒所引起的呼吸道感染。本品与灭活的甲型流感病毒疫苗合用时可促使机体产生预防性抗体。研究食品中金刚烷胺残留含量的检测技术,对于指导进出口食品中金刚烷胺含量控制,有效应对国际贸易和食品安全事件,及时消除潜在的出口贸易障碍,促进相关行业拓展国际市场,具有紧迫的现实意义。
2实验部分
1.1仪器与试剂
1.1.1试剂和材料
甲醇:德国默克,色谱纯;
乙腈:德国默克,色谱纯;
水:1.25L哇哈哈纯净水(杭州产);
三氯乙酸:分析纯
盐酸:分析纯
氨水:分析纯
异丙醇:分析纯
甲酸:色谱纯
鸡肉:取自养殖基地。
标准品:购置于DR公司,纯度>95%。
PCX小柱:agela,150mg/6mL。
标准贮备液:称取各标准品10.0mg,分别放于10ml容量瓶中,用甲醇定容至刻度,4℃保存。
1.1.2仪器
液相色谱—质谱仪(LC-MS-MS) AB5500,ESI源、
电子天平(美国奥豪斯)、
旋转蒸发仪(瑞士Buchi)、
冷冻离心机(美国贝克曼)
研磨仪(德国莱驰)、
超声波清洗器(昆山市超声仪器有限公司)、
棒状均质器(IKA T18)、
涡旋混合器(IKA),
固相萃取器(天津奔腾)。
1.2样品提取
称取2g鸡肉样品(精确至0.01g)至15mL离心管中,加入已知浓度的内标标准品、 5mL甲醇-1%三氯乙酸(50+50,V+V),涡旋30s,超声30min,10000r/min离心10min,上清液全部转移至15mL离心管中,残渣中在加入5mL甲醇-1%三氯乙酸(50+50,V+V),涡旋30s,超声30min,10000r/min离心10min,合并上清液。取5ml上清液过柱
1.3 样品净化
PCX小柱(150mg/6ml),先用5ml甲醇,5ml水活化,上清液过柱,用5ml 2%盐酸,5ml甲醇淋洗抽干,5ml 5%氨水+甲醇+异丙醇洗脱,氮气吹干,用1ml流动相(1‰甲酸水:乙腈95:5体积比)定容
1.4 色谱-质谱条件
液相条件:C18色谱柱,流速0.3ml/min,流动相1‰甲酸水和乙腈梯度洗脱。
质谱条件:电喷雾离子源,正离子扫描,多反应监测,雾化气、辅助气、气帘气、碰撞气调节气体流量使质谱灵敏度达到最佳。
3结果与讨论
3.1 色谱质谱条件的优化
流动相优化如下:
色谱柱:C18,100mm*2.1mm*5um或相当,柱温30℃
流动相:1‰甲酸水:乙腈,流速0.3ml/min,
3.2质谱条件
A. 离子源:电喷雾离子源ESI
B.扫描模式:正离子扫描
C.检测方式:多反应检测(MRM)
D.点喷雾电压:5500V
C.气帘气:35,GS1:45,GS255,DP70,EP10,CXP15,离子源温度500℃
D.定量定性离子和碰撞能量条件如下:
金刚烷胺总离子流图
金刚烷胺选择离子图、棒状图及标准曲线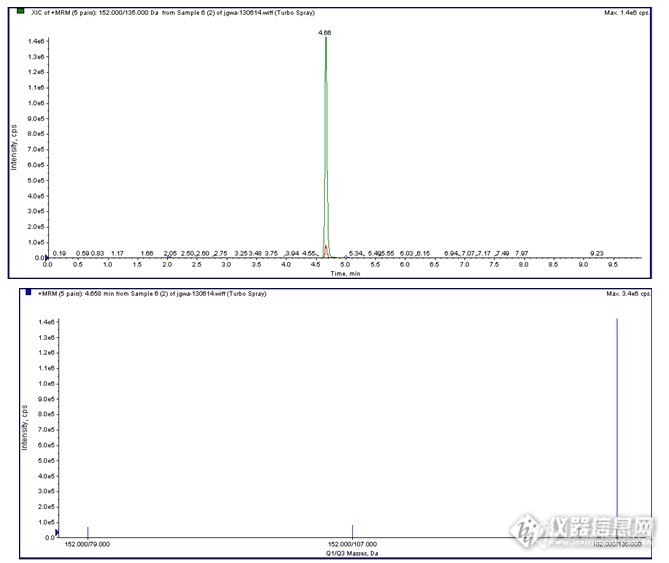
3.2 线性方程
配置混合标准标准系列工作液,浓度为0,0.50,1.0,2.0,4.0,6.0,10.0ug/L。分别以选定的定量离子峰面积与内标物的峰面积的比值对浓度绘制标准曲线,金刚烷胺药物在0.50~10ug/L的范围内呈良好线性,r2均大于0.99。
3.3 回收率试验
取同一批阴性样品,加入适量的混合标准液,使加标量在2ug/kg、5ug/kg、10ug/kg和50ug/k四个浓度,每个浓度做6个平行,求其平均回收率,并计算批内相对标准偏差
4结论
试验证明本方法简便、快速、准确,方法的定量下限为2ug/kg,高效液相色谱串联质谱法测定鸡肉组织中金刚烷胺残留达到目前国际上检测金刚烷胺残留的先进水平,可用于鸡肉中金刚烷胺残留的确证检测。
参考文献
1:李士敏,王玮. 液相色谱- 质谱联用法测定大鼠血浆中盐:酸金刚烷胺浓度及体内药动学研究[J],药物分析杂志,2007, 27(1)
2:戴晓健,陈笑艳,张勇等. 液相色谱- 串联质谱法同时:测定人血浆中金刚烷胺和氯苯那敏[J],药物分析杂志,2006, 26(6)