维权声明:本文为konglong原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。
国产离子色谱-脉冲安培检测器测定饮料中常见的糖类化合物
郎 蕾1,刘格林1,2,施超欧3*
(华东理工大学化学与分子工程学院 分析测试中心,上海 200237)
摘要:使用国产离子色谱系统检测饮料中常见的葡萄糖、果糖、乳糖、蔗糖和麦芽糖,并进行方法学验证。结果表明,5种糖类化合物在各自线性范围内R2不小于0.9990,对葡萄糖、果糖、乳糖、蔗糖和麦芽糖的检出限(RSN=3)分别为3.42 μg·L-1、11.4 μg·L-1;6.76 μg·L-1、22.5 μg·L-1;10.1 μg·L-1。5种糖类化合物的相对标准偏差均小于2.47%,样品的加标回收率范围在94.13% ~ 114.2%之间,均符合相关检测标准要求,能应用于日常实验室的常规糖分析。为考察国产仪器分析的准确性和评价主要模块的性能,与Thermo ICS-5000+离子色谱安培检测系统和Dionex Ultimate 3000-液相色谱示差检测器系统进行比较,对比结果表明,三者的分析结果一致性良好,其中国产脉冲安培离子色谱系统的检出限和定量限比Thermo仪器高3~4倍,除此之外,国产离子色谱仪器各个模块性能稳定,可满足常规糖类化合物含量的测定,填补国产离子色谱在糖类化合物检测领域的空白。关键词:国产离子色谱仪;国产脉冲安培检测器;饮料;糖类化合物中文分类号:O657.7+5 文献标志码:A
Determination of Common Carbohydrate Compounds in Beverages by Ion Chromatography with Pulsed Amperometric Detector Made by Myself
LANG Lei1,LIU Gelin1,2,SHI Chaoou3*
(Analysis and Research Center,East China University of Science and Technology,Shanghai 200237)
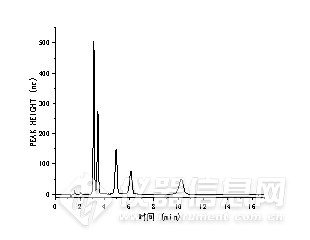
Abstract: Using the self-developed pulse amperometric detector, it is assembled with other domestic instrument components to form a complete set of domestic ion chromatography instruments, and applied to the analysis of glucose, fructose, lactose, sucrose and maltose commonly found in beverages, and methodological verification. The results showed that the R2 of the five carbohydrate compounds was not less than 0.9990 in their respective linear ranges, and the detection limits (RSN=3) for glucose, fructose, lactose, sucrose and maltose were 3.42 μg·L-1 and 11.4 μg·L-1, respectively. 6.76 μg·L-1、22.5 μg·L-1;10.1 μg·L-1。 The relative standard deviation of the five carbohydrates was less than 2.47%, and the spiked recovery of the samples ranged from 94.13% to 114.2%. All meet the requirements of relevant testing standards and can be applied to daily laboratory testing. And in the full import Thermo ICS-5000+ ion chromatography system and Dionex Ultimate 3000 liquid chromatography difference detector repeated the same experimental process, the comparison results show that the analysis results are consistent, but the domestic amperometer detection limit and quantitative limit is 3 to 4 times higher than the imported instrument, the reason for the exploration is that there is a certain gap between the domestic pump and the inlet pump in the stable output mobile phase. The performance of each module and machine of domestic ion chromatography instrument is stable.Keywords:Domestic ion chromatography;Domestic pulse amperometric detector;Soft drinks;Carbohydrate compounds;糖类[1]是植物和动物的主要能量来源,对生理活动等有着极大影响[2]。食品中常见中的糖主要包括葡萄糖、果糖、乳糖、蔗糖和麦芽糖[3]。目前检测食品中糖的测定方法主要有化学法、酶比色法、酶电极法[4-7]、高效液相色谱法[8-12]、气相色谱法[13],毛细管电泳法[14-16]和高效阴离子交换色谱法[17-19]等。其中高效液相色谱法测糖主要包括高效液相色谱-示差折光法、高效液相-蒸发光散射法和高效液相质谱法等。高效液相色谱-示差折光检测法只适用于等度洗脱的测试,且只适用于高浓度含量糖样品的分析,在进行多组分分析时效果不好[20-21]。高效液相色谱-蒸发光散射法对不挥发的溶质具有较高的检测灵敏度,蒸发发光法不受溶剂成分及温度的影响,能够进行梯度洗脱的测试,适于低聚糖的分析。近年来,该方法主要应用于中药材、烟草、食品中糖含量的测定[22-23]。高效阴离子交换色谱-脉冲安培(high performance anion exchange chromatography with pulsed amperometric detection,HPAEC-PAD)法采用NaOH为流动相,并添加NaAc。能实现糖醇、单糖、双糖、寡糖、低聚糖、多糖以及糖衍生物的分析。其在检测糖时主要使用金电极的脉冲安培检测器,可检测ug·L-1级的糖,不需要进行衍生反应[24-25]和复杂的样品纯化处理,基体干扰少,有着较好的方法重复性和稳定性[26]。但是,目前国内所有文献安培法测糖的报道都使用进口检测器,未见国产安培检测器的应用报道。目前带脉冲安培检测器的进口离子色谱仪器价格昂贵,维护费用高。因此,开发国产带脉冲安培检测器的离子色谱仪十分必要。本实验使用GI5000离子色谱系统包含脉冲安培检测器,对饮料中常见的葡萄糖、果糖、乳糖、蔗糖和麦芽糖的分析,进行了相关的方法学实验,并选取了三种市面上常见的含糖饮料进行了检测。与Thermo ICS-5000+离子色谱安培检测系统和Dionex Ultimate 3000液相色谱示差检测器系统进行比较,以此来验证GI5000离子色谱系统在检测糖类化合物方面的性能,从而填补了国产离子色谱仪器对糖类化合物检测的空白,同时考察了国产自研安培检测器和国产泵与进口仪器的性能差距。 1 试验部分 1.1 仪器与试剂GI5000离子色谱系统:包括GI3000软件、四元梯度泵、自动进样器和GI5250安培检测器(包括自研安培检测池、自研参比电极和自研Au工作电极); Thermo ICS 5000+离子色谱系统,包括变色龙7.2软件、SP-DP单元四元梯度泵、AS-AP自动进样器、DC模块(带安培检测器)。Dionex Ultimate 3000液相色谱系统,包括变色龙6.8软件、四元梯度泵、自动进样器、柱温箱和RI-101型示差折光检测器Millipore-Q A10超纯水系统,AL204电子分析天平。5种糖混合标准储备溶液:1.000 g·L-1,称取葡萄糖51.0 mg、果糖50.5 mg、乳糖50.5 mg、蔗糖51.0 mg、麦芽糖51.0 mg于50 mL容量瓶中,加入超纯水充分溶解后定容至刻度,储存于于4 ℃冰箱中冷藏保存,可放置半个月。使用时用超纯水稀释到所需质量浓度。可口可乐溶液:先将可口可乐溶液进行超声处理,用0.22 μm的滤膜进行过滤,称取可乐样品126 mg,加入超纯水稀释50倍。样品溶液:将样品1(脉动饮料)和2(茶π饮料)用0.22μm的滤膜进行过滤,再分别称取496 mg和507 mg于50 ml容量瓶中,加入超纯水定容至刻度,得到浓度为9920 mg·L-1和10140mg·L-1的两份实际样品溶液。使用时用超纯水稀释到所需质量浓度。50% NaOH(W/W)(电子级) 德国Merck公司;D-无水葡萄糖( D-Glucose anhydrous,≥98%) 上海笛柏化学品有限公司;D-果糖(D-Fructose,≥99%)、蔗糖(sucrose,≥99.5%)、麦芽糖(maltose,≥98%) 上海阿拉丁生化科技股份有限公司;无水乳糖(lactose,≥98%) 上海麦克林生化科技有限公司;可口可乐、实际样品1(脉动)和实际样品2(茶π),均为超市购买;实验用水均采用电阻率不低于18.2 MΩ·cm的超纯水。所有试剂使用前均使用0.22 μm的滤膜过滤。1.2 色谱条件GI5000离子色谱系统和Thermo ICS-5000+离子色谱系统:Dionex CarboPac PA1色谱柱(250 mm×4 mm),Dionex CarboPac PA1保护柱(50 mm×4 mm);柱温为30℃;流量为1 ml·min-1;进样量为25 μL;流动相为200 mmolNaOH溶液;安培检测器电位波形为糖标准四电位。图1为5 mg·L-1 5种糖类化合物混合标准溶液在GI5000离子色谱系统中的色谱图。Dionex Ultimate 3000液相色谱系统:Shodex-SP0810色谱柱(8.0 mm×300 mm);柱温70 ℃;流量为1ml·min-1;进样量为25μL;流动相为超纯水。 ![]()
图1 5种糖类混合标准溶液色谱图
Fig.1 Chromatogram of mixed solution of 5 sugar standards
2 结果与讨论2.1 GI5000离子色谱系统与Thermo ICS-5000+离子色谱系统灵敏度对比实验显示GI5000离子色谱仪器的噪音稳定在0.12 nC,而Thermo ICS-5000+离子色谱仪器的噪音稳定在0.02 nC,探索了造成这种现象的原因,首先将与检测器相连接的安培池体部件进行了拆卸,对自研Au工作电极进行打磨维护,冲洗了自研参比电极,重新组装后安装在Thermo安培检测器上,用Thermo DP泵进行测试,观察Au工作电极噪音的变化,结果发现噪音值稳定在0.02 nC,与进口安培池体噪音一致,排除了自研安培池体部件对噪音的影响。又将自研安培池体转移至GI5250安培检测器上并与Thermo DP泵串联起来进行测试,噪音值稳定在0.06 nC,说明GI5250安培检测器自身和国产泵较进口仪器存在一定差距,但已符合日常的检测灵敏度的要求。2.2 方法学验证1)标准曲线分别配置质量浓度为0.2、0.5、1.0、2.0、5.0 mg·L-1的5种糖类化合物混合标准溶液,以质量浓度(x,mg·L-1)为横坐标,以峰面积(y)为纵坐标,绘制标准曲线。各组分的线性范围、线性方程、相关系数、检出限(RSN=3)和定量限(RSN=10)见表1,5种糖类化合物在各自线性范围内线性关系R2不小于0.9990,满足分析方法的要求。Thermo ICS-5000+离子色谱系统对葡萄糖、果糖、乳糖蔗糖和麦芽糖的检出限和定量限分别为1.200 μg·L-1、4.010 μg·L-1;1.830 μg·L-1、6.100 μg·L-1;2.960 μg·L-1、9.860 μg·L-1;6.230 μg·L-1、20.78 μg·L-1;10.15 μg·L-1、33.82 μg·L-1。
表1 GI5000离子色谱仪测定5种糖类化合物的线性数据和检出限
Table 1 The GI5000 ion chromatograph determines linear data and detection limits for five carbohydrate compounds
糖类化合物 | 线性范围/(mg·L-1) | 线性方程 | 相关系数 | 检出限 /(μg·L-1) | 定量限 /(μg·L-1) |
葡萄糖 | 0.2~5 | y = 621.5x + 24.91 | 0.9998 | 3.420 | 11.40 |
果糖 | 0.2~5 | y = 366.7x + 23.92 | 0.9996 | 6.759 | 22.53 |
乳糖 | 0.2~5 | y = 328.0x + 39.46 | 0.9990 | 10.12 | 33.72 |
蔗糖 | 0.2~5 | y = 218.1x + 21.34 | 0.9993 | 20.43 | 68.09 |
麦芽糖 | 0.2~5 | y = 272.5x + 14.95 | 0.9990 | 31.37 | 104.6 |
2)进样重复性取适量的浓度为5 mg·L-1的5种糖类化合物混合标准溶液于进样瓶中,分两批分别在GI5000离子色谱系统和Thermo ICS-5000+离子色谱系统上重复进样8次,记录所测得的峰高和峰面积,计算RSD实验结果如表2所示,表明葡萄糖、果糖、乳糖、蔗糖和麦芽糖的峰高和峰面积RSD≤2.47%,结果稳定,与Thermo ICS-5000+离子色谱系统检测结果的RSD几乎一致,说明了GI5000离子色谱系统在重复性方面与进口仪器保持一致,性能良好,实验结果稳定可靠。 表2 5种糖类化合物进样重复性考察结果
Table 2 Results of repeated sampling of five sugars
糖类化合物 | GI5000 | Thermo ICS-5000+ |
峰高 RSD/(%) | 峰面积 RSD/(%) | 峰高 RSD/(%) | 峰面积 RSD/(%) |
葡萄糖 | 0.57 | 0.48 | 1.41 | 1.56 |
果糖 | 0.56 | 0.48 | 1.98 | 2.19 |
果糖 | 0.72 | 0.91 | 2.17 | 2.54 |
蔗糖 | 0.93 | 2.47 | 1.25 | 1.40 |
麦芽糖 | 0.84 | 1.78 | 0.46 | 0.51 |
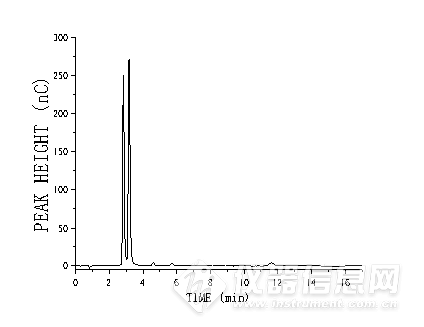
3)5种糖类化合物加标回收率测定对可口可乐样品进行加标回收率实验,对于样品中含有的糖类化合物,以其质量分数的80%、100%和120%进行加标,重复进样5次,计算峰面积的RSD,检测结果如表3所示,样品的加标回收率范围在94.13%~114.2%之间,相对标准偏差在0.22%~4.14%。经计算得,可口可乐中葡萄糖质量浓度为41.6 g·L-1,果糖质量浓度为54.4 g·L-1、乳糖质量浓度为1.5 g·L-1、蔗糖质量浓度为4.1 g·L-1、麦芽糖质量浓度为1.8 g·L-1,总含糖量为103.4 g·L-1,可口可乐厂家标注碳水化合物总量为104.6 g·L-1,误差1.14%,说明检测结果可靠。图2为可口可乐样品色谱图。 表3 5种糖类化合物加标回收率测定结果
Table 3 Determination of the recovery rate of five sugars
糖类化合物 | 本底 /(mg·L-1) | 加标量 /(mg·L-1) | 测得量 /(mg·L-1) | 回收率 /% | 相对标准偏差 /% |
葡萄糖 | 1.955 | 1.600 | 3.553 | 99.88 | 1.80 |
2.000 | 3.899 | 97.20 | 0.38 |
2.400 | 4.214 | 94.13 | 0.22 |
果糖 | 2.140 | 1.600 | 3.693 | 97.80 | 3.83 |
2.000 | 4.073 | 96.65 | 0.25 |
2.400 | 4.629 | 103.7 | 4.14 |
乳糖 | 1.01 | 0.800 | 1.885 | 109.4 | 0.19 |
1.000 | 2.151 | 114.2 | 0.23 |
1.200 | 2.353 | 111.9 | 0.8 |
蔗糖 | 0.774 | 0.800 | 1.544 | 96.25 | 0.97 |
1.000 | 1.847 | 107.4 | 0.17 |
1.200 | 2.043 | 105.8 | 0.15 |
麦芽糖 | 0.892 | 0.800 | 1.755 | 107.9 | 2.72 |
1.000 | 1.915 | 102.3 | 0.45 |
1.200 | 2.128 | 103.0 | 0.75 |
![]()
图2 可口可乐样品色谱图
Fig.2 Coca-Cola sample chromatography
2.3 三种仪器检测结果对比离子色谱法中两种实际样品稀释100倍,液相色谱法中两种实际样品稀释10倍。分别在全进口仪器Thermo ICS 5000+离子色谱系统、GI5000离子色谱系统以及Dionex Ultimate 3000液相色谱仪器上重复进样5针,测试结果如表4所示。 表4 实际样品1和样品2中含糖量测定结果
Table 4 Measurement results of sugar content in actual sample 1 and sample 2
糖类 化合物 | 离子色谱法-Thermo安培 | 离子色谱法-GI5000安培 | 液相色谱法-Dionex示差 |
样品1 | 样品2 | 样品1 | 样品2 | 样品1 | 样品2 |
含糖量/(g·L-1) | 含糖量/(g·L-1) | 含糖量/(g·L-1) | 含糖量/(g·L-1) | 含糖量/(g·L-1) | 含糖量/(g·L-1) |
葡萄糖 | 15.87 | 23.10 | 16.62 | 22.18 | 16.33 | 22.08 |
果糖 | 19.71 | 31.19 | 19.90 | 29.50 | 21.57 | 30.86 |
乳糖 | -- | -- | -- | -- | -- | -- |
蔗糖 | 12.85 | 23.55 | 12.28 | 23.09 | 11.72 | 23.72 |
麦芽糖 | -- | -- | -- | -- | -- | -- |
总含糖量/g/L | 48.43 | 77.84 | 48.80 | 74.77 | 49.62 | 76.66 |
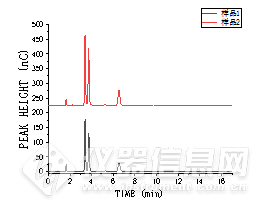
样品1和样品2厂家标注的总含糖量分别为49 g·L-1和75 g·L-1。如表4所示,全进口仪器Thermo ICS 5000+测得两种样品的总含糖量分别为48.43 g·L-1和77.84 g·L-1,GI5000离子色谱系统测得两种样品的总含糖量分别为48.80 g·L-1和74.77 g·L-1。Dionex Ultimate-3000液相色谱示差法测得两种样品的总含糖量分别为49.62 g·L-1和76.66 g·L-1。三种仪器的所测得的两种实际样品中糖类化合物总量相差5%以内,结果均较为准确,同时也证明了国产离子色谱仪器性能稳定可靠。三台仪器对两种实际样品的分离色谱图如图3和4所示。![]()
![]()
图3 样品1和样品2中糖分离色谱图Thermo离子色谱仪(左)、国产离子色谱仪(右)
Fig.3 Separation chromatograms of sugars in samples 1 and 2 Thermo ion chromatograph (left), domestic ion chromatograph (right)
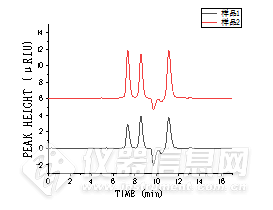
![]()
图4 液相-示差法测得样品1和样品2中糖分离色谱图
Fig.4 Separation chromatogram of sugar in sample 1 and sample 2 by liquid-differential method
3 讨论与结论
通过将GI5250安培检测器和进口仪器相互串联等实验得到GI5000离子色谱系统的检出限和定量限约为全进口仪器的3~4倍,其原因是GI5250安培检测器自身性能与进口检测器存在差距,并且进口泵在稳定输出流动相上优于国产泵。后续需要针对国产安培检测器和泵性能进一步优化。使用GI5000离子色谱系统检测饮料中糖类化合物,进行了方法学测试,对比了全进口Thermo ICS 5000+仪器的检测结果,验证了GI5000离子色谱系统在检测糖类化合物方面的性能。结果显示,5种糖类化合物在0.2~5 mg·L-1范围内线性关系良好,检测的线性相关系数均在0.9990以上,重复性RSD≤2.47%,除麦芽糖外,其余四种糖检出限均在0.1 mg· L-1以内,麦芽糖检出限为0.105 mg·L-1。NY/T 3902-2021标准[27]中葡萄糖的检出限为0.4 mg· L-1、果糖和麦芽糖的检出限为1.2 mg·L-1、蔗糖的检出限为0.6 mg·L-1,表明GI5000离子色谱系统所测得的结果,均能够满足上述相关标准的要求,可满足日常实验室检测需求。以市面上售卖的可口可乐为样品,对5种糖类化合物进行加标回收实验,5种糖类化合物的加标回收率范围为94.13%~114.2%。相对标准偏差在0.22%~4.14%。测得可口可乐中的5种糖类化合物总量为10.34 g/100 g。分别使用全进口仪器Thermo ICS-5000+、GI5000离子色谱系统以及Dionex Ultimate 3000液相色谱仪检测了脉动和茶π饮料中糖类化合物的含量,三种方法检测的结果几乎一致,证明了GI5000离子色谱系统性能的可靠。 参考文献[1] 佚名. 碳水化合物—化学结构[J]. 淀粉与淀粉糖, 2010(2): 36-44.[2] ZHANG Z, KHAN N M, NUNEZ K M, et al. Complete monosaccharide analysis by high-performance anion-exchange chromatography with pulsed amperometric detection[J]. Analytical Chemistry, 2012, 84(9): 4104-4110.DOI:10.1021/ac300176z. [3] 岳虹, 赵贞, 刘丽君, 李翠枝, 邵建波.高效液相色谱法测定发酵乳饮料中果糖、葡萄糖、蔗糖、麦芽糖及乳糖含量[J].乳业科学与技术, 2017, 040(002): 23-26.[4] 樊宏, 陈强. 乳制品中乳糖直接比色测定方法探讨[J]. 中国卫生检验杂志, 2006, 16(3): 296-297.[5] 钟宁, 侯彩云. 三种乳糖检测方法的比较[J]. 食品科技, 2011, 36(7): 263-265. [6] 中华人民共和国卫生部. GB/T 5009.7—2003 食品中还原糖的测定. 北京: 中国标准出版社, 2003.[7] Zhang J L, Dai X, Song Z L, Han R, Ma L Z, Fan G C, Luo X L,One-pot enzyme- and indicator-free colorimetric sensing of glucose based on MnO2 nano-oxidizer, Sensors and Actuators B: Chemical, 2020, 304.[8] ZIELINSKI A A F, BRAGA C M, DEMIATE M I, et al. Development and optimization of a HPLC-RI method for the determination of major sugars in apple juice and evaluation of the effect of the ripening stag[J]. Food Science and Technology, 2013, 34(1): 38-43. DOI:10.1590/S0101-20612014005000003.[9] SHANMUGAVELAN P, KIM S Y, KIM J B, et al. Evaluation of sugar content and composition in commonly consumed Korean vegetables, fruits, cereals, seed plants, and leaves by HPLC-ELSD[J]. Carbohydrate Research, 2013, 380(20): 112-117. DOI:10.1016/j.carres.2013.06.024.[10] MA C M, SUN Z, CHEN C B, et al. Simultaneous separation and determination of fructose, sorbitol, glucose and sucrose in fruits by HPLC-ELSD[J]. Food Chemistry, 2014, 145: 784-788. DOI:10.1016/j.foodchem.2013.08.135.[11] WU X D, JIANG W, LU J J, et al. Analysis of the monosaccharide composition of water-soluble polysaccharides from Sargassum fusiforme by high performance liquid chromatography/electrospray ionisation mass spectrometry[J]. Food Chemistry, 2014, 145: 976-983. DOI:10.1016/j.foodchem.2013.09.019.[12] BAI W D, FANG X D, ZHAO W H, et al. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography[J].Journal of Food Drug Analysis, 2015, 23: 645-651. DOI:10.1016/j.jfda.2015.04.011.[13] HE J Z, XU Y Y, CHEN H B, et al. Extraction, structural characterization, and potential antioxidant activity of the polysaccharides from four seaweeds[J]. International Journal of Molecular Medicine, 2016, 17(12): 1-17. DOI:10.3390/ijms17121988.[14] DANIEL D, LOPES F S, SANTOS V B D, et al. Detection of coffee adulteration with soybean and corn by capillary electrophoresistandem mass spectrometry[J]. Food Chemistry, 2018, 243: 305-310. DOI:10.1016/j.foodchem.2017.09.140.[15] 张欢欢, 李疆, 赵珊, 等. 毛细管区带电泳-间接紫外检测法快速测定食品中乳糖、蔗糖、葡萄糖和果糖[J]. 色谱, 2015, 33(8): 816-821. [16] 马海宁, 华玉娟, 屠春燕, 等. 毛细管电泳法分析藏红花植物细胞多糖中单糖组成[J]. 色谱, 2012, 30(3): 304-308. DOI:10.3724/SP.J.1123.2011.11015.[17] LV X Y, GUO Y X, ZHUANG Y P, et al. Optimization and validation of an extraction method and HPAEC-PAD for determination of residual sugar composition in L-lactic acid industrial fermentation broth with a high salt content[J]. Analytical Methods, 2015, 7: 9076-9083. DOI:10.1039/c5ay01703c.[18] WANG X, XU Y, LIAN Z N, et al. A one-step method for the simultaneous determination of five wood monosaccharides and the corresponding aldonic acids in fermentation broth using highperformance anion-exchange chromatography coupled with a pulsed amperometric detector[J]. Journal of Wood Chemistry and Technology, 2013, 34(1): 67-76. DOI:10.1080/02773813.2013.838268.[19] ZHANG Y, WU J R, NI Q H, et al. Multicomponent quantification of astragalus residue fermentation liquor using ion chromatographyintegrated pulsed amperometric detection[J]. Experimental and Therapeutic Medicine, 2017, 14: 1526-1530. DOI:10.3892/.2017.4673.[20] Young C S . Evaporative light scattering detection methodology for carbohydrate analysis by HPLC.[J]. Cereal Foods World, 2002, 47(1):14-16.[21] 梁亚丽, 张彦玲, 何颖娜. 糖类化合物分离分析方法进展[J]. 河北化工, 2006, (06): 42-44.[22] 梁智安, 王成龙, 龙飞. 液相色谱示差折光法测定酒中的总糖和还原糖[J].食品安全质量检测学报, 2018, 9(09): 2188-2194.[23] 陈琴呜, 刘文英. HPLC—ELSD在中药糖类分析中的应用[J]. 中草药, 2008, 39(6): 955-957.[24] BAI W D, FANG X D, ZHAO W H, et al. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography[J].Journal of Food Drug Analysis, 2015, 23: 645-651. DOI:10.1016/j.jfda.2015.04.011.[25] HE J Z, XU Y Y, CHEN H B, et al. Extraction, structural characterization, and potential antioxidant activity of the polysaccharides from four seaweeds[J]. International Journal of Molecular Medicine, 2016, 17(12): 1-17. DOI:10.3390/ijms17121988.[26] INDORF C, BODé S, BOECKX P, et al. Comparison of HPLC methods for the determination of amino sugars in soil hydrolysates[J]. Analytical Letters, 2013, 46: 2145-2164. DOI:10.1080/00032719.2013.796558.[27] 水果、蔬菜及其制品中阿拉伯糖、半乳糖、葡萄糖、果糖、麦芽糖和蔗糖的测定 离子色谱法:NY/T 3902-2021. 2021.