几种酶的酶活力检测方法及结果分析
西安国联质量检测技术股份有限公司
安评中心:王涛
大蒜属百合科葱属植物蒜的鳞茎,其风味独特,营养丰富,用途十分广泛。在生产上,大蒜不能通过杂交制种,只能采用其鳞茎繁殖,由于长时间的营养繁殖造成植株体内病毒积累,使得蒜头变小,品种退化,产量降低,大大降低了大蒜的商品价值。大蒜在长期的生长过程中,由于受到病原菌的植物的附着与侵入,会产生自身的抗性机制,其中的保护性反应是复杂的新陈代谢的结果,其生理反应是通过酶催化活动来实现的。这些酶包括抗病性酶超氧岐化酶SOD,多酚氧化酶PPO和过氧化物酶POD等,以及感病性酶纤维素酶和果胶酶。
本文主要描述了大蒜苗中的SOD,PPO,POD,纤维素酶和果胶酶的酶活力检测方法,并从酶活的角度分析,大蒜茎尖脱毒技术可以有效提高SOD,PPO,POD等与植物抗病性有关的酶的活性,而与植物感病性有关的酶的活性如纤维素酶和果胶酶的活性有所降低,其中脱毒苗中的SOD,PPO和POD的活性分别比未脱毒苗相应地高出93.37 U/g,19.48 U/g·min和382.55 U/g·min,纤维素酶和果胶酶的活性则分别低出18.29 U/g·min和38.08 U/g·min。这就从植物生理的角度上验证了脱毒大蒜苗抗病和高产的原因。
1实验药品及仪器
1.1缓冲液的配置1.1.1磷酸缓冲液的配置
首先分别配置母液A、B,再根据质量分数分别取对应的母液,调pH即可。母液A:0.2 mol/L Na
2HPO
4溶液:称量71.63 g Na
2HPO
4·12H
2O,定容至1 L。
母液B:0.2 mol/L NaH
2PO
4溶液:称量31.21 g NaH
2PO
4·2H
2O,定容至1 L。
0.05 mol/L磷酸缓冲液(pH7.8,内含1%PVP):22.875 mL A +2.125 mL l B+1 g聚乙烯吡咯烷酮(PVP),稀释至100 mL。
0.05 mol/L磷酸缓冲液(pH6.0):3.075 mL A + 21.925 mL B,稀释至100 mL。
0.1 mol/L磷酸缓冲液(pH6.0):12.3 mL A + 87.7 mL B,稀释至200 mL。
1.1.2醋酸缓冲液的配置
同磷酸缓冲液一样,先配置母液。
母液A:0.2 mol/L HAc溶液:吸取11.5 mL 醋酸溶液,定容至1 L。
母液B:0.2 mol/L NaAc溶液:称量27.2 g 三水合乙酸钠,定容至1 L。
0.2 mol/L (pH4.6) 醋酸缓冲液:51 mL A + 49 mL B混合均匀即可。
0.2 mol/L(pH4.8)醋酸缓冲液:40 mL A + 60 mL B混合均匀即可。
1.1.3其他试剂的配置
100 umol/L EDTA-Na
2溶液:称取0.03721 g EDTA-Na
2,用磷酸缓冲液定容至1 L。
20 umol/L核黄素:称取0.00753 g核黄素定容至1 L。
130 mmol/L甲硫氨酸(Met):称取1.9399 gMet,用磷酸缓冲液定容至100mL。
750 umol/L氮蓝四唑(NBT):称取0.06133 g NBT,用磷酸缓冲液定容至100 mL。
0.1 mol/L邻苯二酚:称取1.1011 g邻苯二酚定容至100 mL。
20%三氯乙酸(TCA):称取20 g TCA定容至100 mL。
二氧甲基酚即愈创木酚
30%H
2O
2 3,5-二硝基水杨酸显色剂(DNS显色剂):称取2.5 g DNS溶于水中,加入2.5 g氢氧化钠、50 g酒石酸钾钠和100 mL水,加热溶解后再加入0.5 g苯酚和0.125 g无水亚硫酸钠,待全部溶解后冷却,定容至500 mL,贮于棕色瓶中,放置一周后使用,用之前过滤
。
葡萄糖标准液:称取0.54 g葡萄糖定容至500 mL。
纤维素底物(CMC):称取0.625 g羧甲基纤维素钠溶于0.2 mol/L (pH 4.6) 醋酸缓冲液中,定容至100 mL。
果胶底物:称取0.5 g果胶溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL,放置冰箱内冷藏。
D-半乳糖醛酸标准液:称取0.1 g D-半乳糖醛酸溶于0.2 mol/L (pH 4.8) 醋酸缓冲液中,定容至100 mL。
1.2主要实验仪器紫外分光光度计 上海精密科学仪器有限公司
可见光分光光度计 上海第三分析仪器厂
TCL-16C型台式离心机 上海安亭科学仪器厂
超净工作台 上海博迅实业有限公司医疗设备厂
电热恒温水浴锅 上海跃进医疗器材厂
灭菌器 上海申安医疗器械厂
海尔冰箱 青岛海尔集团
电子分析天平 北京赛多莉斯天平有限公司
数显pH计;恒温光照培养箱;制冰机;计时器;
移液枪;试剂瓶;容量瓶。
2实验方法
2.1材料大蒜脱毒试管苗:采用大蒜茎尖组织脱毒技术,经过3次继代培养所获得的生长健壮脱毒苗。
大蒜苗植株:将市售山东金乡大蒜,分瓣去皮后,栽种于花盆中,日光照射,生长两个月之后所得植株。
2.2方法共测两组植株(第一组为大蒜脱毒苗,第二组为大蒜苗植株即未脱毒苗)的五种酶的酶活,这五种酶分别是超氧化物歧化酶、多酚氧化酶、过氧化物酶、纤维素酶和果胶酶,最后将两组酶活数据分别做对应比较。同一植株做三次平行实验,取平均值。
3酶活测定
3.1超氧物歧化酶(SOD)活力的测定本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性的大小。在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生超氧阴离子自由基,这种自由基可将氮蓝四唑还原为蓝色的甲腙。后者在560 nm处有最大吸收,而SOD可清除超氧阴离子自由基,从而抑制了甲腙的形成。于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
3.1.1粗酶液的提取
取叶片于预冷的研钵中,加入1 mL 0.05 mol/L磷酸缓冲液(pH 7.8,内含1%PVP)在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心10 min,取上清液,冷藏待用。
3.1.2显色反应
取7只5 mL透明度好的试管,用记号笔编号,1为空白管,2~4为测定管,5~7为对照管。各管按照表3-1依次添加试剂溶液,混匀后,将空白管置于暗处,其它各管置于4000 lx日光灯下反应20 min。
表1 测定SOD活性试剂添加量
Table 1 The add content of reagent to SOD
试剂 | 用量/ mL | 备注 |
0.05 mol/L磷酸缓冲液 | 1.5 | |
130 mmol/L Met | 0.3 | |
750 umol/L NBT | 0.3 | 总体积为3.0 ml,对照管与空白管加入缓冲液代替酶液 |
100 umol/L EDTA-Na2 | 0.3 |
20 umol/L 核黄素 | 0.3 | |
酶液 | 0.05 | |
蒸馏水 | 0.25 | |
3.1.3活力测定与计算
以暗处管为空白,分别测定其它各管在560 nm波长下的吸光度(OD)。以抑制NBT光化还原的50%作为一个酶活性单位(U)表示。按下式计算SOD的总活性:
SOD总活性(U/g)=(A
o-A
s)*V
t/ A
o*0.5*W*V
1 (公式3-1)
式中:SOD总活性以每克鲜质量的酶单位表示(U/g);A
o-照光对照管的吸光度;A
s-样品管的吸光度;V
t-样品液总体积(mL);V
1-测定时样品液用量(mL);W-样品鲜质量(g)。
3.2多酚氧化酶(PPO)活力的测定多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化生成醌,其活性可以用比色法测量产物的形成,邻苯二酚是其常用的底物。
3.2.1粗酶液的提取
取叶片于预冷的研钵中,加入2 mL 0.05 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。
3.2.2活力测定与计算
取2支试管,一支为空白对照管,对照管中加入1 mL酶液+3 mL 0.05 mol/L(pH 6.0)磷酸缓冲液;另一支为测定管,测定管中加入1 mL酶液+1 mL 0.1 mol/L邻苯二酚+2 mL 0.05 mol/L(pH 6.0)磷酸缓冲液。然后在37 ℃水浴保温10 min,立即冰浴,冷却下来之后,各管加入2 mL 20% TCA终止反应。立即在410 nm波长下测定吸光度,每min测一次,共测3 min。以每min内吸光度变化0.01为酶活性单位(U)。
PPO活性(U/g·min)=ΔA*V
0/0.01W*V
1*t
(公式3-2)
式中:ΔA = A
s-A
o;A
o-对照管的吸光度;A
s-测定管的吸光度;V
0-酶液提取总量(mL);V
1-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。
3.3过氧化物酶(POD)活力的测定选用愈创木酚法,即在过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,可用分光光度计测量生成物的含量。
3.3.1反应混合液的制备
量取50 mL 0.1 mol/L磷酸缓冲液(pH6.0),加入28 uL二氧甲基酚,加热搅拌至溶解,冷却后再加入19 uL 30% H
2O
2,混合均匀保存于冰箱中。
3.3.2粗酶液的提取
取叶片于预冷的研钵中,加入5 mL 0.1 mol/L磷酸缓冲液(pH 6.0),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,冷藏待用。
3.3.3活力测定与计算
取2只比色杯,一只加入2 mL反应混合液和1 mL 0.1 mol/L磷酸缓冲液(pH 6.0),作为校零对照;另一只加入2 mL反应混合液和1 mL酶液,立即开启秒表计时器,在470 nm波长下测定吸光度,每隔1 min读数一次。以每min吸光度变化0.01为1个过氧化物酶活性单位(U)。
POD活性=△A*Vt /0.01W* V
1*t (公式3-3)
式中:△A-反应时间内吸光度的变化量;V
t-酶液总体积(mL);V
1-测定时酶液用量(mL);W-样品鲜重(g);t-反应时间(min)。
3.4纤维素酶活力的测定选用DNS法测定纤维素酶活力。DNS法测定的是纤维素酶对羧甲基纤维素钠(CMC)的糖化能力,其水解产物如纤维二糖和葡萄糖是还原糖,可以将DNS还原成棕红色的氨基化合物,在一定浓度范围内,还原糖的量与该物质溶液颜色的深浅成比例,因此可以用分光光度计进行测定,该方法可表示纤维素酶的总活力。
3.4.1绘制葡萄糖标准曲线
取5支试管,用记号笔编号后,按表3-2量取试剂,每管分别加入1 mL 2 mol/L氢氧化钠和2 mL DNS显色液,摇匀后置于沸水浴中加热5 min,流水冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于490 nm波长处测吸光度,绘制标准曲线。
表2葡萄糖标准曲线制作表
Table 2 Standard curve of Glucose
试管号 | 标准葡萄糖溶液(mL) | 0.2 mol.L-1,pH4.6醋酸钠缓冲溶液(mL) | 试管中葡萄糖量(umol) |
1 | 0 | 5.0 | 0 |
2 | 0.4 | 4.6 | 2.4 |
3 | 0.6 | 4.4 | 3.6 |
4 | 0.8 | 4.2 | 4.8 |
5 | 1.0 | 4.0 | 6.0 |
3.4.2粗酶液的提取
取叶片于预冷的研钵中,加入2 mL 0.2 mol/L醋酸缓冲液(pH 4.6),在冰浴下研磨匀浆,匀浆液装入2 mL离心管中,在4000 r/min下离心15 min,取上清液,装入离心管中再离心10 min,定容至10 mL,冷藏待用。
3.4.3活力测定与计算
取3支试管,一支作为空白对照,另2支作为平行样品。样品管中加入50℃预热的酶液1 mL,底物溶液(CMC)4 mL;空白对照管加4 mL底物溶液(CMC)。3支试管放入50℃水浴中,5 min后取出,立即加入1 mL 2mol/L NaOH溶液和2 mL DNS显色剂。摇匀后,空白对照管中加入1 mL酶液,立即将3支试管放入沸水浴中,反应5 min后取出,流水冷却,定容至10 mL,在490 nm波长处测吸光度。用测得的OD值在标准曲线上差得相应的葡萄糖的量,代入下面公式计算活力。以每min催化纤维素水解成1 umol葡萄糖的酶量表示酶活大小(U)。
纤维素酶活性(U/g·min)=葡萄糖量/5*E* W (公式3-4)
式中:5为反应时间(min);Ew为1 mL酶液中含有的酶量(g);W-样品鲜重(g)。
3.5果胶酶活力的测定选用DNS法测定果胶酶活力。该方法是利用果胶酶在一定温度,时间和条件下水解果胶,释放出还原性D-半乳糖醛酸,与3,5-二硝基水杨酸共热产生棕红色的氨基化合物,即发生显色反应。在一定范围内,水解生成D-半乳糖醛酸的量与吸光度成正比,与果胶酶活力成正比,通过分光光度计测定吸光度,可以计算出果胶酶的活力。
3.5.1绘制D-半乳糖醛酸标准曲线
取6支试管,编号后依次按照表3-3加入试剂,摇匀后置于沸水浴中反应5 min后,冷却,用蒸馏水定容至10 mL,静置20 min后以1号管为对照于540 nm波长处测吸光度,绘制标准曲线。
表3 D-半乳糖醛酸标准曲线的绘制
Table 3 Standard curve of D-Galacturonic acid
试管号 | D-半乳糖醛酸标准液(mL) | 0.2 mol.L-1,pH4.8醋酸缓冲液(mL) | DNS显色液(mL) |
1 | 0 | 4.0 | 2.5 |
2 | 0.2 | 3.8 | 2.5 |
3 | 0.4 | 3.6 | 2.5 |
4 | 0.6 | 3.4 | 2.5 |
5 | 0.8 | 3.2 | 2.5 |
6 | 1.0 | 3.0 | 2.5 |
3.5.2粗酶液的提取
与提取纤维素酶的方法相同。
3.5.3活力测定与计算
取5支试管,用记号笔编号。1、2号管为样品管,分别加入1 mL果胶底物,在48℃水浴中预热5 min,再分别加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),之后,1号管中加入1 mL酶液,立即摇匀,在48℃水浴中反应30 min;2号管中加入1 mL酶液,立即放入沸水浴中反应5 min,冷却。分别取1、2管中容液各2 mL于3、4管中,并加2 mL水,2.5 mL DNS显色剂,混匀,沸水浴反应5 min,流水冷却。5号管加入4 mL 0.2 mol/L醋酸缓冲液(pH 4.8),2.5 mL DNS显色剂,静置20 min后以5号管为对照校零,在540 nm波长处测3、4管的吸光度;用测得的(OD
3-OD
4)值在标准曲线上查得相应的D-半乳糖醛酸的量,代入下面公式计算活力。以每min酶作用生成的D-半乳糖醛酸的量为一个酶活单位(U)。
果胶酶活性(U/ g·min)=Y*3*N/t* W
(公式3-5)
式中:Y-酶作用生成的D-半乳糖醛酸的量;3-测酶活取了反应液的1/3;N-样品稀释倍数;W-样品鲜重(g);t-反应时间(min)
4标准曲线的绘制
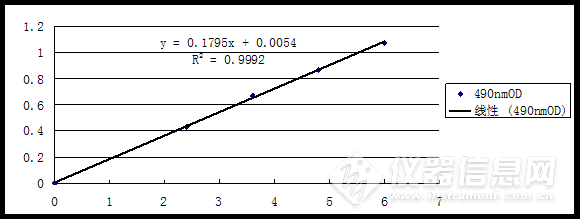
4.1葡萄糖标准曲线依照3.4.1步骤,最后测得各个试管中的吸光度依次为0,0.432,0.672,0.865,1.073。按照表4,以葡萄糖浓度为横坐标,490 nm处的OD值为纵坐标,绘制葡萄糖标准曲线(如图1)。
表4葡萄糖标准曲线
Table 4 Standard curve of Glucose
试管号 | 1 | 2 | 3 | 4 | 5 |
葡萄糖浓度umol | 0 | 2.4 | 3.6 | 4.8 | 6 |
490 nm OD | 0 | 0.432 | 0.672 | 0.865 | 1.073 |
![]()
图1葡萄糖标准曲线
Figure 1 Standard curve of Glucose
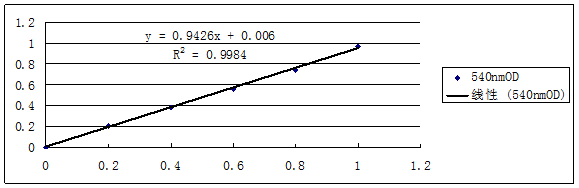
4.2 D-半乳糖醛酸标准曲线依照3.5.1步骤,最后测得各个试管中的吸光度依次为0,0.211,0.384,0.561,0.743,0.965。按照表5,以D-半乳糖醛酸的量为横坐标,540 nm处的OD值为纵坐标,绘制D-半乳糖醛酸标准曲线(如图2)。
表5 D-半乳糖醛酸标准曲线
Table 5 Standard curve of D-Galacturonic acid
试管号 | 1 | 2 | 3 | 4 | 5 | 6 |
D-半乳糖醛酸的量mL | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
540 nm OD | 0 | 0.211 | 0.384 | 0.561 | 0.743 | 0.965 |
![]()
图2 D-半乳糖醛酸标准曲线
Figure 2 Standard curve of D-Galacturonic acid
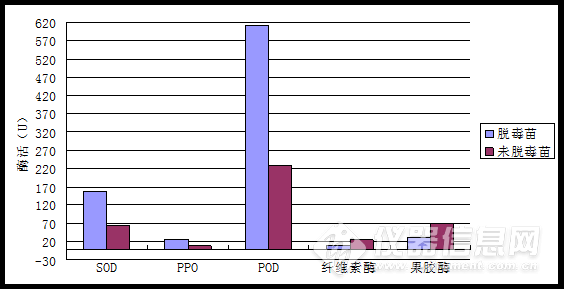
5结果与分析将所测得的OD值,根据各个公式计算出SOD,PPO,POD,纤维素酶和果胶酶的酶活力,结果如表6所示。再将大蒜脱毒试管苗与未脱毒苗酶活测定结果做成柱状图进行比较,如图3所示。可以看出,脱毒试管苗中的SOD,PPO,POD的活性均高于未脱毒试管苗的对应酶的活性,而这三种酶都与植物的抗病性有关,说明在抗病性上脱毒试管苗强于未脱毒试管苗;纤维素酶和果胶酶的活性则是未脱毒苗比脱毒试管苗高。
此外,作为植物抗氧化系统第一道防线的SOD,其活性大小在脱毒试管苗与未脱毒苗中相差93.37 U/g,前者比后者高出约1.5倍,说明经脱毒的试管苗抵御活性氧侵害的能力更高。PPO能催化木质素及其他酚类氧化物的形成,从而构成保护性屏蔽,抵抗抗病菌的入侵,也可以通过形成醌类物质直接发挥抗病作用。脱毒试管苗的PPO活性比未脱毒苗的PPO活性高出19.48 U/g·min,约2.45倍。说明脱毒苗在抵抗抗病菌的入侵方面,能力更强。在植物对病原菌侵染的防卫反应中,POD和SOD都有着极其重要的作用,SOD能有效的清除机体内的超氧自由基,它可以把有害的超氧自由基转化为过氧化氢,而POD可以将过氧化氢分解为完全无害的水,在脱毒试管苗与未脱毒苗中POD的活性均比较大,两者相差382.55 U/g·min,约1.7倍,说明经脱毒的试管苗可以更有效的抵御过氧化氢的毒害。而纤维素酶和果胶酶均与植物的感病性有关,其活性则是未脱毒苗比脱毒试管苗高,分别高出18.29 U/g·min和38.08 U/g·min,约2.4倍和1.2倍,说明脱毒苗的感病几率有所降低。
POD不仅可以将过氧化氢分解为完全无害的水,而且还具有多种生理功能,如从叶绿体和细胞质中去除过氧化氢、氧化有毒化合物、合成细胞壁、对各种胁迫的应急、吲哚-3-乙酸的调控、乙烯的生物合成等,还参与了植物酚类的聚合和氧化以及木质素和植保素的合成。因此POD是植物体中活性较高的一种酶,从图3中也可以看出,POD的活性在五种酶中最高。
表6 大蒜脱毒试管苗与未脱毒苗酶活测定结果
Table 6 Enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets
酶总活性 | SOD (U/g) | PPO (U/g·min) | POD (U/g·min) | 纤维素酶 (U/g·min) | 果胶酶 (U/g·min) |
脱毒苗 | 157.46 | 27.43 | 610.95 | 7.77 | 31.97 |
未脱毒苗 | 64.09 | 7.95 | 228.40 | 26.06 | 70.05 |
![]()
图3大蒜脱毒试管苗与未脱毒苗酶活测定结果比较
Table 3 Comparison of enzyme activity assay results between virus-free garlic in vitro and not virus-free plantlets