今天主要讲讲SEC方法开发过程中的一般考量,SEC的方法开发相比于RP会略微的简单一些,并不会很复杂。
01.SEC方法开发的一般步骤
1)确定溶剂、温度和相化学组合:在购买色谱柱之前,参考聚合物-溶剂参考表(Polymer-To-Solvent Reference Table)来确定适用于您应用的相和溶剂。(参考链接:https://www.agilent.com.cn/cs/library/technicaloverviews/public/5991-6802CHCN.pdf)2)确定样品的分子量范围:根据先验知识或产品相关知识,估算样品的分子量范围;也可以用技术手段鉴定样品的分子量。
3)对样品进行预处理:根据样品性质选择合适的溶剂进行溶解;去除样品中的杂质或干扰物,如蛋白质沉淀、离心或过滤;如果需要,进行样品浓缩或稀释,以适应色谱系统的要求。
4)选择色谱模式:SEC模式;流动相的组成通常是无机盐缓冲溶液(如磷酸盐缓冲溶液、Tris-HCl盐缓冲溶液等)。
5)选择检测器:根据样品的化学性质和检测需求选择合适的检测器,如紫外-可见光(UV-Vis)、示差折光检测器(RI)或蒸发光散射检测器(ELSD),确定检测器的参数设置;偶尔也会联用。
6)选择分离条件:设定流速,通常在0.2-1.0 mL/min之间;设定柱温,以优化分离效果。
7)预料、识别和解决潜在问题:预料可能出现的问题,如柱堵塞、样品降解、峰形不佳等;识别问题的原因,如样品溶剂不兼容、流动相污染等;解决问题,如更换色谱柱、优化流动相组成、调整样品处理方法等。
8)进行方法的部分验证和系统稳定性测试:进行系统适用性测试,包括理论板数、拖尾因子和分离度;进行部分方法验证,包括准确度、精密度、线性范围、检测限和定量限、耐用性;测试系统稳定性,包括连续运行条件下的系统变异性。
9)优化和调整:根据初步实验结果,优化分离条件,如调整缓冲盐比例、流速或柱温;调整检测器参数,以提高灵敏度和选择性。
10)最终验证:进行全面的方法验证,包括交叉验证和独立实验室验证;确定方法的可靠性和重现性。
![]()
图1.SEC方法开发的一般步骤
02.SEC方法开发的调整考量
1)流速的优化
a. 分辨率与流速的关系:在尺寸排阻色谱中,降低流速可以提高分辨率,因为这有助于减少扩散和提高分子在柱内的停留时间,从而实现更好的分离。然而,较低的流速也会增加分析时间,因此需要在分辨率和分析效率之间找到平衡。b. 系统压力与流速的关系:较高的流速可能会增加系统压力,特别是当使用较长的柱子或较小的粒径的填料时。系统压力的增加可能导致泵性能下降或柱子损坏,因此需要监控并优化流速以保持在系统的压力限制内;SEC色谱柱耐压一般都较小。c. 样品性质与流速的关系:不同的样品可能需要不同的流速来实现最佳分离。例如,对于较大的蛋白质或聚合物,可能需要较高的流速来减少扩散和保持合理的分析时间。2)柱温的优化
a. 保留时间与柱温的关系:理论上,在SEC中温度对保留时间没有影响,因为SEC分离是基于熵驱动的分配过程,而非吸附过程。然而,在实际操作中,温度可能会通过改变蛋白质的构象间接影响保留时间。b. 流动相粘度与柱温的关系:温度的升高通常会降低流动相的粘度,从而增加分子在柱内的扩散性。这可能会影响分离效率和分辨率。c. 分析时间与柱温的关系:在某些情况下,提高柱温可以减少分析时间,但这可能会以牺牲分辨率为代价。d. 系统压力与柱温的关系:提高柱温通常会降低流动相的粘度,从而降低系统压力,但在实际操作中,如果柱温升高导致样品的溶解度降低或色谱柱的性能下降,可能会间接增加系统的压力。SEC分离通常在10~30℃下进行。e. 样品稳定性与柱温的关系:在方法开发过程中,需要确保所选的柱温不会影响样品的稳定性,特别是在分析温度敏感的生物分子时。3)流动相的优化
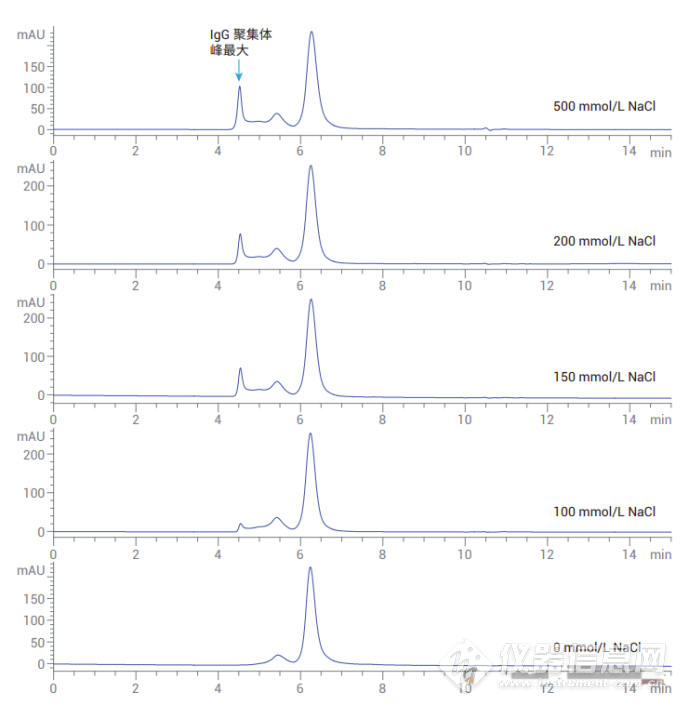
a. 缓冲盐组成与流动相的关系:流动相通常由水相缓冲液组成,如磷酸盐缓冲液或Tris缓冲液,常与氯化钠等盐类配合使用。有时,对于特定的生物分子,可能还会添加有机溶剂,如乙腈或甲醇。优化缓冲液和盐浓度是最大程度提高色谱柱分离效果的关键部分,其目的在于避免造成峰拖尾、峰变形、分离度不佳的次级相互作用以及由流动相引起的蛋白质聚集 。
b. 离子强度与流动相的关系:调整流动相的离子强度可以减少填料与蛋白质之间的次级相互作用。例如,增加氯化钠的浓度可以减少单体的峰拖尾现象并使峰形更窄 。c. pH与流动相的关系:流动相的pH值对蛋白质的电荷状态和因此与其与填料的相互作用有显著影响。选择合适的pH值可以优化蛋白质的分离 。d. 缓冲液浓度与流动相的关系:缓冲液的浓度也会影响蛋白质的分离。过高的缓冲液浓度可能导致蛋白质聚集,从而影响分析结果。通常,较低的缓冲液浓度有利于获得更好的分离效果 。 ![]()
图2.不同 NaCl 浓度下的 IgG 色谱图
03.SEC方法开发的注意事项
1)流动相的组成:选择合适的流动相组成,如水/盐溶液的比例,以确保样品的溶解性和稳定性。流动相的粘度和pH值对分离效果有显著影响。
2)检测器的选择:根据样品的特性选择合适的检测器,如紫外-可见光、荧光或示差折光检测器,并确保检测波长适合样品且流动相无吸收。
3)流速的选择:流速会影响分离度和分析时间。通常,降低流速可以提高分离度,但会增加分析时间。在满足分离度的前提下,适当提高流速可以缩短分析时间。
4)柱温的选择:柱温对样品的溶解度和稳定性有影响。升高柱温可以减少流动相的粘度,提高柱效,但也可能影响样品的构象。选择适宜的柱温以保持蛋白质的天然构象和避免变性
5)色谱柱的选择:根据样品的分子量范围选择合适的色谱柱孔径和粒径,以确保有效的分离。
![]()
总结一下:在开发SEC方法时,我们通常需要考虑以下几个关键点:首先,得根据样品的分子量和溶解性来挑选合适的溶剂和色谱柱。接着,对样品进行适当的预处理,以确保它们在分析过程中保持稳定。选择合适的流速和柱温也很重要,这两者都会影响分析时间和分辨率。此外,流动相的组成,包括缓冲液的类型和浓度,需要适当调整,以减少样品与柱填料之间的次级相互作用。最后,选择一个适合样品特性的检测器,确保它能够在所需的波长下有效检测。在整个过程中,我们还得留意系统的压力限制,避免过高的压力损坏色谱柱。简而言之,SEC方法开发虽然相对简单,但每一步都需要细致的考量和优化,以确保获得高质量的分析结果。