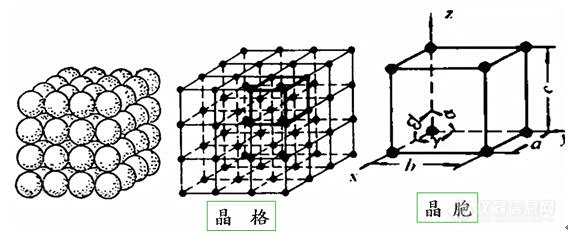
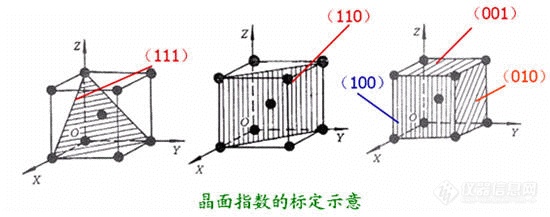
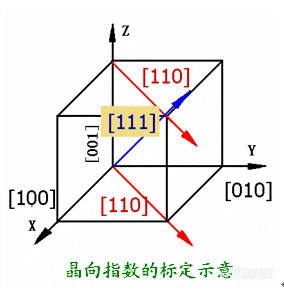
第二章 材料的结构2.1 原子的结合方式
工程材料通常是固态物质,是由各种元素通过原子、离子或分子结合而成的。
结合键:组成物质的质点(原子、分子或离子)之间的互相作用而联系在一起的结合力;
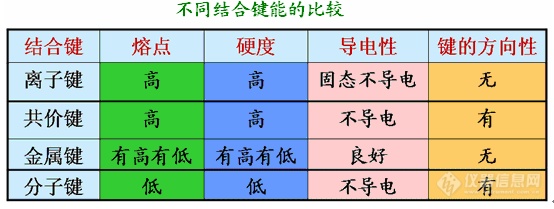
结合键的分类:离子键、共价键、金属键和弱键。
2.1.1 离子键
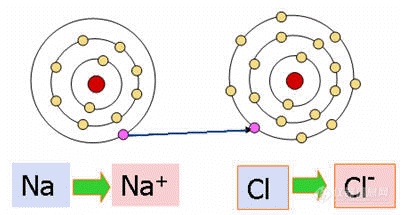
离子键的形成条件:当周期表中相隔较远的正电性元素原子和负电性元素原子相互接近时,正电性元素原子失去外层电子变为正离子,负电性原子获得电子变为负离子,当引力与离子间的斥力相等时便形成稳定的离子键(如下图所示)。
离子键的特点:离子键结合力大,因而通过离子键结合的材料强度高、硬度高、熔点高、脆性大。由于离子键难以移动输送电荷,所以这类材料都是良好的绝缘体。由于离子的外层电子被牢固束缚,难于被光激发,离子键结合的材料不能吸收可见光,是无色透明的。
![]()
2.1.2 共价键
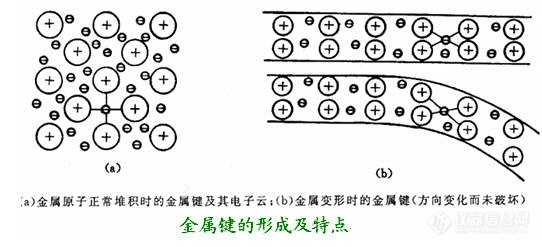
共价键的形成条件:两个相同原子或性质相差不大的原子互相靠近,电子不会转移,原子间借共用电子对所产生的力而结合,形成共价键。如金刚石、SiC。如下图所示为1个硅原子通过共用电子与其他4个硅原子形成共价键的示意图。这种通过共用电子形成的结合键称为共价键。多工程构件需要焊接成型。可焊性是指材料易于被焊到一起并获得优质焊缝的能力。钢的含碳量直接影响可焊性,含碳量低,可焊性越好。
通过共价键结合的材料的特点:通过共价键结合的材料具有强度高、硬度高、熔点高、脆性大的特点。其导电性依共价键的强弱而不同。弱共价键的锡是导体,硅是半导体,而金刚石是绝缘体。具有离子键和共价键的工程材料多为陶瓷或高分子聚合物。
![]()


 [flash]http://files.instrument.com.cn/bbs/upfile/200892321925.swf[/flash]
[flash]http://files.instrument.com.cn/bbs/upfile/200892321925.swf[/flash]