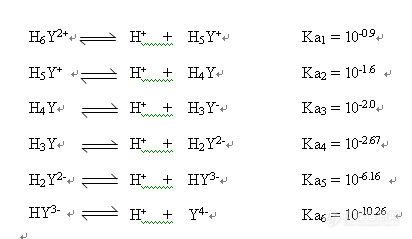
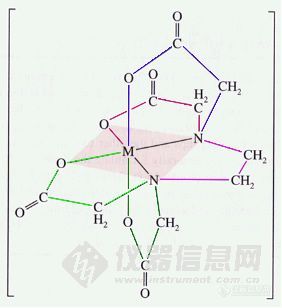
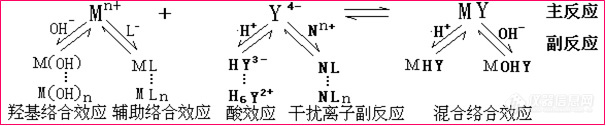
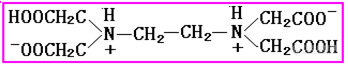酸度不同,EDTA与金属离子的配合能力就不同了。
[Y]总 [Y]总
把 αY(H)= [Y] = 带入KMY
[Y] αY(H)
[MY] [MY] ·αY(H)
KMY = = = K′MY·αY(H)
[M]·[Y] [M]·[Y′]
log K′MY = log KMY - logαY(H)
式中K′MY称为条件稳定常数,随酸度增大而减小。
例:已知logKMgY = 8.70
在pH=10时,logαY(H)= 0.45
log K′MgY = logKMgY - logαY(H)= 8.70-0.45 = 8.25
在pH=5时,logαY(H)= 6.45
则log K′MgY = logKMgY - logαY(H)=8.70– 6.45 = 2.25
由上述例题可见:pH值与log K′MY之间关系,因此实际工作中用条件稳定常数更能说明配合物在某一pH时的实际稳定程度。
条件稳定常数:K'MY → KMY' → KM'Y → KM'Y'
4、准确滴定的判别式
配位滴定要求测定误差在一定范围内,测定达到一定准确度,要求配位反应能够定量地完成。要求必须符合log c·K'MY ≥6,以此作为金属离子能否用配位滴定法测定的依据。
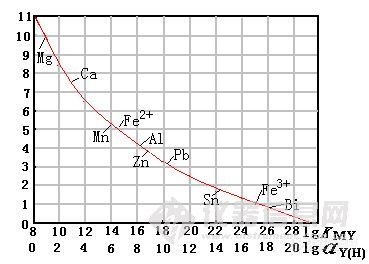
6、EDTA酸效应曲线
设金属离子浓度为0.02mol/L,则滴定要求
log KMY′≥ 8 ①
log KMY′= logKMY - logαY(H) ②
logαY(H) = logKMY - logKMY′ ③
将①代入③中 logαY(H)≤ logKMY -8
将p229页表7-8EDTA配合物的logKMY值代入公式中即可。
例:求EDTA滴定Zn2+的最高允许的酸度。
解:按Zn2+为0.02mol/L 来考虑,由logαY(H)≤logKMY –8
计算最高允许酸度:logαY(H) = logKMY -8