原文由 tangtang(tangtang) 发表:这个方法是我们集团实验室提供的,反应式是不对的,应该是原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:
我才佩服楼主有勇气正视和纠正错误,但是我又不得不再次佩服楼主有勇气把同样的错误再犯一次。
请先弄清楚反应方程式:
FeO + 2HCl = FeCl2 + H2O
6FeCl2 + k2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2kCl + 7H2O
再弄清楚重铬酸钾和FeO之间mol数的对应关系,FeO的分子量71.8444。
按重铬酸钾浓度为0.002319mol/L,样品重量0.3041g,消耗体积11.15ml,空白0.10ml,FeO含量如何算出来是13.0463%的?请楼主将计算过程写出来。
现在这个不是参加原创大赛的问题了,是个很严重的问题,这个我们其它实验给我们的参考方法,所以一定要调查清楚才行的,现在我将方法原文贴出来,大家一起帮忙找问题,拜托了,要是公司有奖励,参与者有份哈。
从楼主给的文档中,反应式为:
2FeO + K2Cr2O7+ 4H2SO4 ® Fe2(SO4)3+ Cr2O3 + K2SO4 + 4H2O
那么1molK2Cr2O7对应2molFeO,请楼主用K2Cr2O7的mol浓度,乘以消耗体积,乘以FeO分子量,除以样品量看看。
方法本身也许没有问题,但是数据是怎么得出来的?有没有实际做实验?
原文由 云☆飘☆逸(denx5201314) 发表:原文由 tangtang(tangtang) 发表:
我也要更正一下,我在查阅其他文献是用盐酸反应的,所以举的方程式是盐酸的。不适用于此篇用硫酸的。此篇讨论应以楼主给的文档中的方程式为基础,在此说明。
和什么酸没有关系,反应的重点是Cr6+变成Cr3+,Fe2+变成Fe3+,数据是有问题,文档有密码我打不开。看不了
原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:
我才佩服楼主有勇气正视和纠正错误,但是我又不得不再次佩服楼主有勇气把同样的错误再犯一次。
请先弄清楚反应方程式:
FeO + 2HCl = FeCl2 + H2O
6FeCl2 + k2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2kCl + 7H2O
再弄清楚重铬酸钾和FeO之间mol数的对应关系,FeO的分子量71.8444。
按重铬酸钾浓度为0.002319mol/L,样品重量0.3041g,消耗体积11.15ml,空白0.10ml,FeO含量如何算出来是13.0463%的?请楼主将计算过程写出来。
tangtang版主,我已经求证过了,你说的反应式是对的,但是,我们用的滴定度也是没有问题的,理由很简单,验证试验用的重铬酸钾不是试验方法写的0.002319,而是称取了别的重量,这个不难理解吧?就是说你可以根据你的样品含量来调整重铬酸钾的浓度,不可能不变。举个很简单的例子,你已经知道样品含量很低,你完全可以配很稀的重铬酸钾浓度,一成不变是教条主义。
原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:这个方法是我们集团实验室提供的,反应式是不对的,应该是原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:
我才佩服楼主有勇气正视和纠正错误,但是我又不得不再次佩服楼主有勇气把同样的错误再犯一次。
请先弄清楚反应方程式:
FeO + 2HCl = FeCl2 + H2O
6FeCl2 + k2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2kCl + 7H2O
再弄清楚重铬酸钾和FeO之间mol数的对应关系,FeO的分子量71.8444。
按重铬酸钾浓度为0.002319mol/L,样品重量0.3041g,消耗体积11.15ml,空白0.10ml,FeO含量如何算出来是13.0463%的?请楼主将计算过程写出来。
现在这个不是参加原创大赛的问题了,是个很严重的问题,这个我们其它实验给我们的参考方法,所以一定要调查清楚才行的,现在我将方法原文贴出来,大家一起帮忙找问题,拜托了,要是公司有奖励,参与者有份哈。
从楼主给的文档中,反应式为:
2FeO + K2Cr2O7+ 4H2SO4 ® Fe2(SO4)3+ Cr2O3 + K2SO4 + 4H2O
那么1molK2Cr2O7对应2molFeO,请楼主用K2Cr2O7的mol浓度,乘以消耗体积,乘以FeO分子量,除以样品量看看。
方法本身也许没有问题,但是数据是怎么得出来的?有没有实际做实验?
6FeO + K2Cr2O7+ 13H2SO4 ® 3Fe2(SO4)3+ Cr2(SO4)3 + K2SO4 + 13H2O,也就是说W(FeO)%=6*m(K2Cr2O7)*M(FeO)**(V2-V0)100/1000M(K2Cr2O7),这个计算式没有问题。只是实际做滴定验证时,改变了重铬酸钾的浓度,不再是0.002319mol/L,这个应该可以吧?实验肯定是做了的,当然,你也可以怀疑,这是你的权利,但是请不要随便攻击,没这个必要,你说呢?
原文由 abcpgf(abcpgf) 发表:原文由 云☆飘☆逸(denx5201314) 发表:原文由 tangtang(tangtang) 发表:
我也要更正一下,我在查阅其他文献是用盐酸反应的,所以举的方程式是盐酸的。不适用于此篇用硫酸的。此篇讨论应以楼主给的文档中的方程式为基础,在此说明。
和什么酸没有关系,反应的重点是Cr6+变成Cr3+,Fe2+变成Fe3+,数据是有问题,文档有密码我打不开。看不了
是的,计算公式中T=6*m(K2Cr2O7)*M(FeO)/M(K2Cr2O7),这个没有问题吧?我的理解是:我可不可以在做实验的时候改变重铬酸钾的浓度,我可以根据样品含量的高低来调整我的重铬酸钾的浓度,我可以配0.01,也可以配0.1,难道说这两种浓度的滴定度也一样?一层不变是不可能的,也是不现实的。
原文由 tangtang(tangtang) 发表:原文由 abcpgf(abcpgf) 发表:原文由 云☆飘☆逸(denx5201314) 发表:原文由 tangtang(tangtang) 发表:
我也要更正一下,我在查阅其他文献是用盐酸反应的,所以举的方程式是盐酸的。不适用于此篇用硫酸的。此篇讨论应以楼主给的文档中的方程式为基础,在此说明。
和什么酸没有关系,反应的重点是Cr6+变成Cr3+,Fe2+变成Fe3+,数据是有问题,文档有密码我打不开。看不了
是的,计算公式中T=6*m(K2Cr2O7)*M(FeO)/M(K2Cr2O7),这个没有问题吧?我的理解是:我可不可以在做实验的时候改变重铬酸钾的浓度,我可以根据样品含量的高低来调整我的重铬酸钾的浓度,我可以配0.01,也可以配0.1,难道说这两种浓度的滴定度也一样?一层不变是不可能的,也是不现实的。
那么请明确,本次试验所用的滴定液浓度。
原文由 tangtang(tangtang) 发表:原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:
我才佩服楼主有勇气正视和纠正错误,但是我又不得不再次佩服楼主有勇气把同样的错误再犯一次。
请先弄清楚反应方程式:
FeO + 2HCl = FeCl2 + H2O
6FeCl2 + k2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2kCl + 7H2O
再弄清楚重铬酸钾和FeO之间mol数的对应关系,FeO的分子量71.8444。
按重铬酸钾浓度为0.002319mol/L,样品重量0.3041g,消耗体积11.15ml,空白0.10ml,FeO含量如何算出来是13.0463%的?请楼主将计算过程写出来。
tangtang版主,我已经求证过了,你说的反应式是对的,但是,我们用的滴定度也是没有问题的,理由很简单,验证试验用的重铬酸钾不是试验方法写的0.002319,而是称取了别的重量,这个不难理解吧?就是说你可以根据你的样品含量来调整重铬酸钾的浓度,不可能不变。举个很简单的例子,你已经知道样品含量很低,你完全可以配很稀的重铬酸钾浓度,一成不变是教条主义。
这场讨论的起源,就是从文中所提供的数据,得出的是错误的结果。既然用的是别的重量配制的重铬酸钾滴定液,那么请将数据发上来继续讨论。
原文由 tangtang(tangtang) 发表:原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:这个方法是我们集团实验室提供的,反应式是不对的,应该是原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:
我才佩服楼主有勇气正视和纠正错误,但是我又不得不再次佩服楼主有勇气把同样的错误再犯一次。
请先弄清楚反应方程式:
FeO + 2HCl = FeCl2 + H2O
6FeCl2 + k2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2kCl + 7H2O
再弄清楚重铬酸钾和FeO之间mol数的对应关系,FeO的分子量71.8444。
按重铬酸钾浓度为0.002319mol/L,样品重量0.3041g,消耗体积11.15ml,空白0.10ml,FeO含量如何算出来是13.0463%的?请楼主将计算过程写出来。
现在这个不是参加原创大赛的问题了,是个很严重的问题,这个我们其它实验给我们的参考方法,所以一定要调查清楚才行的,现在我将方法原文贴出来,大家一起帮忙找问题,拜托了,要是公司有奖励,参与者有份哈。
从楼主给的文档中,反应式为:
2FeO + K2Cr2O7+ 4H2SO4 ® Fe2(SO4)3+ Cr2O3 + K2SO4 + 4H2O
那么1molK2Cr2O7对应2molFeO,请楼主用K2Cr2O7的mol浓度,乘以消耗体积,乘以FeO分子量,除以样品量看看。
方法本身也许没有问题,但是数据是怎么得出来的?有没有实际做实验?
6FeO + K2Cr2O7+ 13H2SO4 ® 3Fe2(SO4)3+ Cr2(SO4)3 + K2SO4 + 13H2O,也就是说W(FeO)%=6*m(K2Cr2O7)*M(FeO)**(V2-V0)100/1000M(K2Cr2O7),这个计算式没有问题。只是实际做滴定验证时,改变了重铬酸钾的浓度,不再是0.002319mol/L,这个应该可以吧?实验肯定是做了的,当然,你也可以怀疑,这是你的权利,但是请不要随便攻击,没这个必要,你说呢?
我疑惑的是,从所提供的数据上看,不能得出文中的结果。灯不拨不亮,理不辩不明。也许质疑的语气有些不妥,那么也请楼主用数据来澄清。
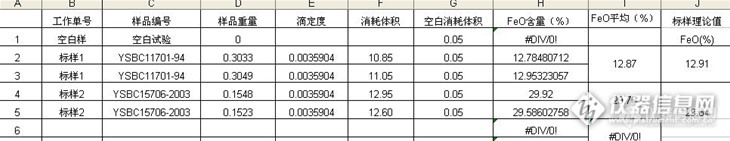
原文由 云☆飘☆逸(denx5201314) 发表:既然是做方法验证,那就不可能一成不变,当然要试试不同的重量,不然你又要说我造数据了呀。数据上传了,看清楚再下结论,不要心口开河,我这个是实验验证的数据,天平我们精确到0.0001g。原文由 tangtang(tangtang) 发表:原文由 abcpgf(abcpgf) 发表:原文由 tangtang(tangtang) 发表:
我才佩服楼主有勇气正视和纠正错误,但是我又不得不再次佩服楼主有勇气把同样的错误再犯一次。
请先弄清楚反应方程式:
FeO + 2HCl = FeCl2 + H2O
6FeCl2 + k2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2kCl + 7H2O
再弄清楚重铬酸钾和FeO之间mol数的对应关系,FeO的分子量71.8444。
按重铬酸钾浓度为0.002319mol/L,样品重量0.3041g,消耗体积11.15ml,空白0.10ml,FeO含量如何算出来是13.0463%的?请楼主将计算过程写出来。
tangtang版主,我已经求证过了,你说的反应式是对的,但是,我们用的滴定度也是没有问题的,理由很简单,验证试验用的重铬酸钾不是试验方法写的0.002319,而是称取了别的重量,这个不难理解吧?就是说你可以根据你的样品含量来调整重铬酸钾的浓度,不可能不变。举个很简单的例子,你已经知道样品含量很低,你完全可以配很稀的重铬酸钾浓度,一成不变是教条主义。
这场讨论的起源,就是从文中所提供的数据,得出的是错误的结果。既然用的是别的重量配制的重铬酸钾滴定液,那么请将数据发上来继续讨论。
说的太多没有意义,1/6重铬酸钾应该为0.05mol/L。我本没怎么想发言,对于一错再错的计算,如果认为我针对你,那么我没什么说的。我只不过就数据进行分析。