可溶性硫酸盐中硫的测定
目的原理
实验目的
1. 了解晶形沉淀的沉淀条件、原理和沉淀方法;
2. 练习沉淀的过滤、洗涤和灼烧的操作技术;
3. 测定可溶性硫酸盐中硫的含量,并用换算因数计算测定结果。
实验原理
测定硫酸根所用的经典方法,都是用Ba2+离子将SO42-离子沉淀为BaSO4沉淀经过滤、洗涤和灼烧后,以BaSO4形式称量,从而求得S或SO42-离子含量,但费时较多。用各种滴定分析方法进行测定,准确度均不及重量法,精密度也不太好。多年来,分析工作者对重量法测定SO42-离子曾作过不少改进,克服了烦琐、费时的缺点,因此重量法仍为一种较准确而重要的标准方法。
BaSO4的溶解度很小Ksp = 8.7×10-11,100ml溶液中在25℃时仅溶解0.25mg,在过量沉淀剂存在下,溶解度更小,一般可以忽略不计。BaSO4性质非常稳定,干燥后的组成与分子式符合。但是BaSO4沉淀初生成时,一般形成细小的晶体,过滤时易穿过滤纸,引起沉淀的损失,因此进行沉淀时,必须注意创造和控制有利于形成较大晶体的条件。
为了防止生成BaCO3、Ba3(PO4)2(或BaHPO4)及Ba(OH)2等沉淀,应在酸性溶液中进行沉淀。同时适当提高酸度,增加BaSO4的溶解度,以降低其相对过饱和度,有利于获得颗粒较大的纯净而易于过滤的沉淀,一般在0.05mol/L左右HCl溶液中进行沉淀。溶液中也不允许有酸不溶物和易被吸附的离子(如Fe3+、NO3-等离子)存在,否则应预先予以分离或掩蔽。Pb2+、Sr2+ 离子干扰测定。
应用玻璃砂芯坩埚抽滤BaSO4沉淀,然后烘干、称重,这样可缩短分析时间,其准确度比灼烧法稍差,但可用于工业生产的快速分析。
用BaSO4重量法测定SO42-离子这一方法应用很广。磷肥、萃取磷酸、水泥以及有机物中硫含量等都可用此法分析。
仪器药品
瓷坩埚2只,坩埚钳1把。
2mol/dm3 1% HCl溶液,10% BaCl2溶液,0.1mol/ dm3AgNO3溶液,6mol/ dm3溶液,定性滤纸 (7-9cm)1张,定量滤纸。
过程步骤
准确称取在100-120℃干燥过的试样0.2-0.3g ,(有些水合盐类试样不能放放烘箱中干燥。本实验可用无水芒硝Na2SO4作试样。)置于400ml烧杯中,用水25ml溶解,(若有水不溶残渣,应该将它过滤除去,并用稀盐酸洗涤残渣数次,再用水洗至不含Cl-离子为止。)加入2mol/dm3HCl溶液5ml,用水稀释至约200ml。加热至沸,在不断搅拌下逐滴滴加5-6mL10%热BaCl2溶液。为了控制晶形沉淀的条件,除试液应稀释和加热外,沉淀剂BaCl2溶液也可先加水适当稀释并加热。
试样中若含有Fe3+离子等干扰离子,在加BaCl2溶液沉淀之前,可加入1%EDTA溶液5ml加以掩蔽。
静置1-2min让沉淀沉降,然后在上层清液中加1-2滴BaCl2溶液,检查沉淀是否完全。此时若无沉淀或浑浊产生,表示沉淀已经完全,否则应再加1-2ml BaCl2稀溶液,直至沉淀完全。然后将溶液微沸10min,在约90℃保温陈化约1h。冷至室温,用慢速定量滤纸过滤,再用热蒸馏水洗涤沉淀至无Cl-离子为止。
检查洗液中有无Cl-离子的方法是加硝酸酸化了的AgNO3溶液,若无白色浑浊产生,表示Cl-离子已洗尽。
将沉淀和滤纸移入已在800—850℃灼烧至恒重的瓷坩埚中,烘干、灰化后,再在800—850℃下灼烧至恒重。坩埚放入电炉前,应用滤纸吸去其底部和周围的水,以免坩埚因骤热而炸裂。沉淀在灼烧时,若空气不充足,则BaSO4易被滤纸的碳还原为BaS,将使结果偏低,此时可将沉淀用浓H2SO4润湿,仔细升温,灼烧,使其重新转变BaSO4。
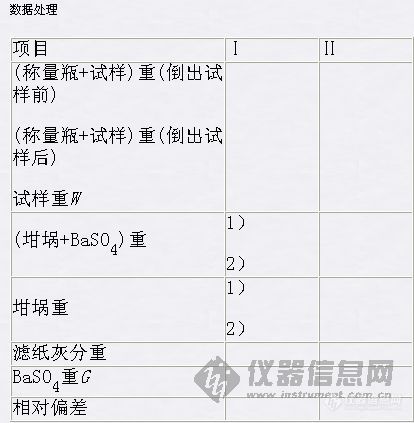
根据所得BaSO4质量,计算试样中含硫(或SO3)的百分率。
![]()
分析思考
1 重量法所称试样重量应根据什么原则计算?加10%BaCl2溶液5-6ml沉淀剂用量应该怎样计算?如果用H2SO4沉淀Ba2+离子,H2SO4用量应如何计算?
2 为什么试液和沉淀剂都要预先稀释,而且试液要预先加热?
3 加入沉淀剂后,沉淀是否完全,应如何检查?沉淀完毕后,为什么要保温放置一段时间后才进行过滤?
4 洗涤至无Cl-离子的目的和检查Cl-离子的方法如何?为什么要控制在一定酸度的盐酸介质中进行沉淀?
5 用倾泻法过滤有什么优点?
6 什么叫恒重?怎样才能把灼烧后的沉淀称准?
7 用SO3表示硫酸根的含量(百分率),应如何计算?