免疫抑制性肿瘤微环境(immunosuppressive tumor microenvironment, ITME)的存在是导致当前肿瘤免疫治疗效果不佳的主要原因之一,诱导肿瘤细胞发生免疫原性细胞死亡(immunogenic cell death,ICD)已成为改善ITME的有效策略。竹节香附素A(Raddeanin A,RA)是中药竹节香附中天然的三萜皂苷,对肝癌、卵巢癌、肺癌等均具有良好的抗肿瘤活性,然而目前RA的抗癌作用机制尚未明确,特别是在抗肿瘤免疫方面。
竹节香附素A可直接靶向反式激活应答DNA结合蛋白-43(transactive responsive DNA-binding protein 43, TDP-43),激活mtDNA-cGAS/STING通路诱导肿瘤细胞发生免疫原性细胞死亡,促进树突状细胞依赖性CD8+ T细胞的激活,从而为临床上肿瘤的免疫治疗提供了新思路。
1、筛选确定竹节香附素A是潜在ICD诱导剂HMGB1是公认的ICD标志物之一,为了确定可能诱导肿瘤细胞死亡和增强T细胞反应的新化合物,作者通过建立了HMGB1-Gluc报告基因筛选模型,结合三种细胞共培养体系(小鼠B16-OVA细胞、小鼠骨髓来源的树突状细胞BMDCs和CD8+ T细胞杂交瘤细胞B3Z),从天然生物活性小分子化合物库(2569种天然产物)中发现竹节香附素A表现出良好的诱导ICD和激活T细胞的活性。此外,RA能显著提高共培养的CD8+ T细胞分泌的IL-2、IFN-γ、GZMB和TNF-α水平,促进BMDCs成熟,增强其抗原呈递功能,在小鼠体内诱导产生免疫记忆效应。[img=图片,1,]data:image/svg+xml,%3C%3Fxml version='1.0' encoding='UTF-8'%3F%3E%3Csvg width='1px' height='1px' viewBox='0 0 1 1' version='1.1' xmlns='http://www.w3.org/2000/svg' xmlns:xlink='http://www.w3.org/1999/xlink'%3E%3Ctitle%3E%3C/title%3E%3Cg stroke='none' stroke-width='1' fill='none' fill-rule='evenodd' fill-opacity='0'%3E%3Cg transform='translate(-249.000000, -126.000000)' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E[/img]
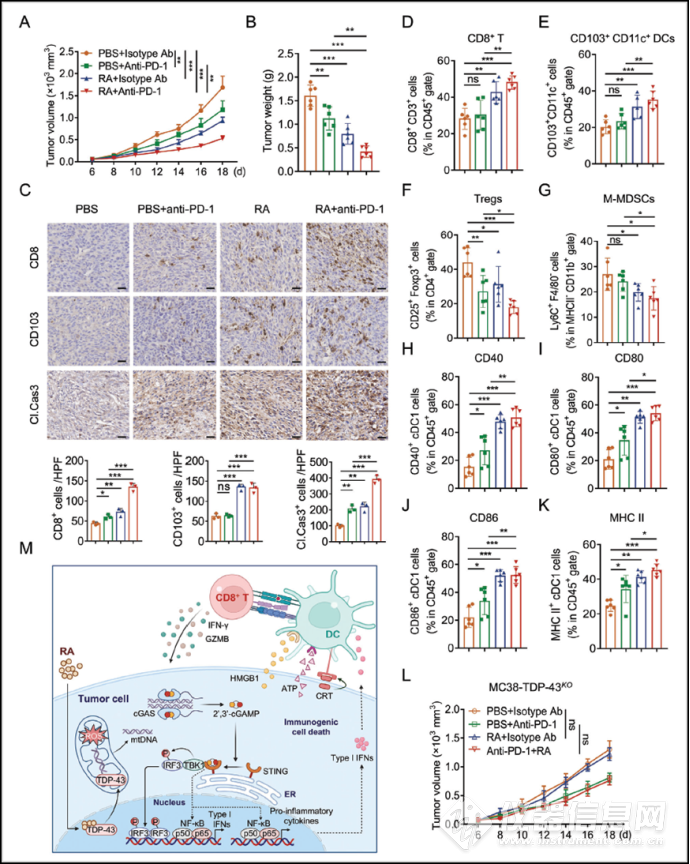
2、竹节香附素A处理的肿瘤细胞促进树突状细胞介导的T细胞活化接下来,作者确定了RA处理的肿瘤细胞激活T细胞和DC的能力。结果显示在与RA预处理的肿瘤细胞共培养的B3Z T细胞中,T细胞来源的IL-2和IFN-γ的上清液水平显著上调,同时伴随着T细胞活化标志物CD69的表达水平升高。由于DC在肿瘤抗原与T细胞的交叉呈递中起着关键作用,作者发现RA处理的肿瘤细胞显著增加了 BMDC上激活标志物的表面表达。数据表明RA治疗的肿瘤细胞促进DCs成熟和随后的CD8 T细胞活化(3、竹节香附素A通过激活抗肿瘤免疫抑制肿瘤生长接着,作者通过体内研究发现,RA抑制MC38荷瘤小鼠肿瘤大小和肿瘤重量。此外,肿瘤浸润淋巴细胞(TIL)谱分析显示,RA显著升高肿瘤浸润性 CD8 T 细胞和 CD103 CD11 DC的数量。同时, RA增加肿瘤微环境(TME)中CD8 T细胞效应分子GZMB和IFN-γ的水平,这意味着RA增强了体内有效T细胞的活化。而在T细胞功能缺陷的BALB / c裸鼠中,RA未能抑制MC38的肿瘤生长,通过细胞色素c(Cyt c)耗尽了DC消除了 RA 对 MC38肿瘤生长的抑制,表明抗原呈递对 RA 介导的抗肿瘤作用至关重要,RA可以通过DCs和CD8 T细胞依赖性方式抑制肿瘤生长4、竹节香附素A触发cGAS/STING依赖性NF-κB和I型IFN信号激活为了研究RA如何诱导肿瘤细胞ICD,作者开展了RNA-seq,发现NF-κB和I型IFN信号转导相关基因显著富集,并通过qPCR证实。报告基因测定同样表明RA触发了MC38细胞中的NF-κB和I型IFN通路激活。为了鉴定调节RA介导的NF-κB和I型IFN激活的先天免疫传感器,作者删除部分可调节 NF-kB和 I 型IFN通路的已知基因,发现缺乏细胞质DNA传感器cGAS和STING导致 NF-kB和I型IFN通路显著减弱。此外,cGAS和STING特异性抑制剂阻止 RA 处理的 MC38 细胞中 Ifnb1 和 Tnf 的表达,这些结果表明cGAS/STING是调节RA介导的肿瘤细胞免疫原性的重要免疫传感器(5、竹节香附素A直接结合反式响应性DNA结合蛋白43(TDP43)为进一步研究RA调控cGAS/STING通路的机制,作者通过Pulldown+MS筛选RA在肿瘤细胞中的潜在结合蛋白,发现反式激活应答DNA结合蛋白-43(TDP-43)可能为RA诱导ICD的直接作用靶点。TDP-43是一种定位于细胞核的DNA和RNA结合蛋白,已有研究表明,TDP-43可在细胞核与细胞质间穿梭,且TDP-43的C端富含甘氨酸结构域,该结构域发生突变(A315T/Q331K)可诱导TDP-43进入线粒体并诱导释放mtDNA到细胞质中激活cGAS/STING。随后作者通过Pulldown+WB、CETSA和SPR等验证两者存在直接互作,分子对接和突变实验证实了结合位点6、RA 触发 mtDNA 泄漏到细胞质中以激活 cGAS/STING 信号传导接下来,作者推测TDP-43可能有助于RA诱导的cGAS/STING信号转导上调。结果显示RA诱导的cGAS/STING下游信号分子的激活,而在TDP-43 KO细胞中被消除。RA触发的Ifnb1和Tnf表达也因TDP-43耗竭而显著降低。TDP-43 能够在细胞核和胞质溶胶之间穿梭,作者发现RA处理显著增加了线粒体中TDP-43的富集,导致线粒体功能损伤,而TDP-43的消耗阻止了RA介导的线粒体功能损伤。细胞免疫荧光显示RA 处理增加了细胞质mtDNA和cGAS之间的共定位,但TDP-43的耗竭中消除。这些发现可能表明与TDP-43结合的RA会触发线粒体不稳定和mtDNA泄漏到细胞质中,从而激活cGAS/STING信号传导7、RA诱导免疫细胞浸润,增强抗PD1治疗疗效作者接着研究了RA和抗PD-1联合治疗在MC38肿瘤模型中是否具有协同抗肿瘤作用,结果显示RA与PD-1抗体的联合治疗实现了最佳的肿瘤生长抑制,且RA和抗PD-1抗体组合导致肿瘤浸润CD8 T细胞的比例高于单独使用任何一种疗法,且肿瘤浸润CD8 T细胞产生的效应分子(包括IFN-γ和GZMB)显著增加。此外,在RA和抗PD-1联合治疗后,MC38肿瘤浸润cDC1也显示CD40、CD80、CD86和MHC-II表达上调,这些发现表明,RA通过重编程免疫微环境增强了抗PD-1的抗肿瘤功效。而RA和抗PD-1联合治疗未能抑制TDP-43 KO小鼠的肿瘤生长,表明RA介导的肿瘤生长抑制主要是由于TDP-43依赖性调节。[img=图片,1,]data:image/svg+xml,%3C%3Fxml version='1.0' encoding='UTF-8'%3F%3E%3Csvg width='1px' height='1px' viewBox='0 0 1 1' version='1.1' xmlns='http://www.w3.org/2000/svg' xmlns:xlink='http://www.w3.org/1999/xlink'%3E%3Ctitle%3E%3C/title%3E%3Cg stroke='none' stroke-width='1' fill='none' fill-rule='evenodd' fill-opacity='0'%3E%3Cg transform='translate(-249.000000, -126.000000)' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E[/img]
![]()