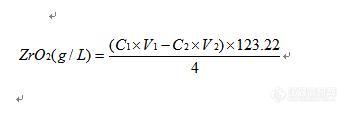维权声明:本文为chenshaoj原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。
原文由 zlhuang0132(zlhuang0132) 发表:
返滴定法是滴定分析中比较常用的方法,它可用于滴定反应慢,没有合适指示剂,试液会封闭指示剂等情况。
四价锆测定比较常用的方法是EDTA滴定,用酸碱滴定的返滴定法原理也是可以测定的,但加碱生成氢氧化物沉淀后,再用酸返滴定时,由于高价金属离子的氢氧化物体积疏松,吸留和包夹现象比较明显,还可能生成碱式盐、多氢氧基的桥式结构沉淀等原因,定组成上有一些困难,另外,过滤再滴则氢氧化物过滤较慢,吸杂严重,洗涤次数过多,不滤吧,絮状沉淀会吸附指示剂,终点变色不敏锐,因此,很少用酸碱滴定法(返滴定)测定金属离子浓度。不过楼主已经做了实验,表明精密度可以,方法还是可行的,建议用标准样多做几组试验,尤其是不同浓度、不同温度的标准液测定试验(浓度高时表面吸收会更严重),看有没有很好的重现性和准确度。
锆的返滴定法测量,还是建议用EDTA络合滴定法。你用直接滴定法肯定是不行的,因为锆氧离子的水解性很强,不可能在PH4-5下测定,建议在水溶液中加入过量EDTA,调PH1左右,适当加热促进络合,然后在室温下用醋酸钠或六次甲基四胺溶液小心中和到PH5-5.5,用铅标准溶液滴定或锌标准溶液滴定(XO指示)。这样就可避免锆的水解了。
谢谢提出宝贵意见,我就是想用EDTA返滴定法来测定,但苦于没有方法,直接加入过量的EDTA硫酸锆早就水解了,根本不能与EDTA络合,你的意思是先将硫酸锆溶液调节至PH=1,然后在加入EDTA加热络合吗?
锆溶液直接加过量EDTA,由于PH值急剧升高(EDTA溶液的PH值4.4左右),水解比络合来得快,因此出现白色混浊,沉淀一旦生成,再通过络合作用来溶解就困难一些了。
原文由 zlhuang0132(zlhuang0132) 发表:
返滴定法是滴定分析中比较常用的方法,它可用于滴定反应慢,没有合适指示剂,试液会封闭指示剂等情况。
四价锆测定比较常用的方法是EDTA滴定,用酸碱滴定的返滴定法原理也是可以测定的,但加碱生成氢氧化物沉淀后,再用酸返滴定时,由于高价金属离子的氢氧化物体积疏松,吸留和包夹现象比较明显,还可能生成碱式盐、多氢氧基的桥式结构沉淀等原因,定组成上有一些困难,另外,过滤再滴则氢氧化物过滤较慢,吸杂严重,洗涤次数过多,不滤吧,絮状沉淀会吸附指示剂,终点变色不敏锐,因此,很少用酸碱滴定法(返滴定)测定金属离子浓度。不过楼主已经做了实验,表明精密度可以,方法还是可行的,建议用标准样多做几组试验,尤其是不同浓度、不同温度的标准液测定试验(浓度高时表面吸收会更严重),看有没有很好的重现性和准确度。
锆的返滴定法测量,还是建议用EDTA络合滴定法。你用直接滴定法肯定是不行的,因为锆氧离子的水解性很强,不可能在PH4-5下测定,建议在水溶液中加入过量EDTA,调PH1左右,适当加热促进络合,然后在室温下用醋酸钠或六次甲基四胺溶液小心中和到PH5-5.5,用铅标准溶液滴定或锌标准溶液滴定(XO指示)。这样就可避免锆的水解了。
谢谢提出宝贵意见,我就是想用EDTA返滴定法来测定,但苦于没有方法,直接加入过量的EDTA硫酸锆早就水解了,根本不能与EDTA络合,你的意思是先将硫酸锆溶液调节至PH=1,然后在加入EDTA加热络合吗?