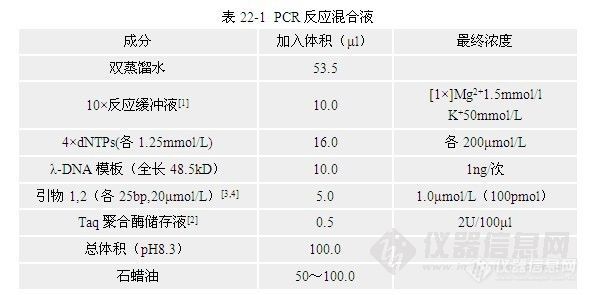
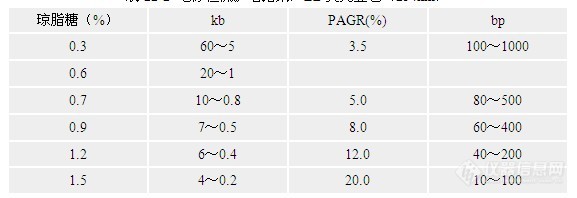
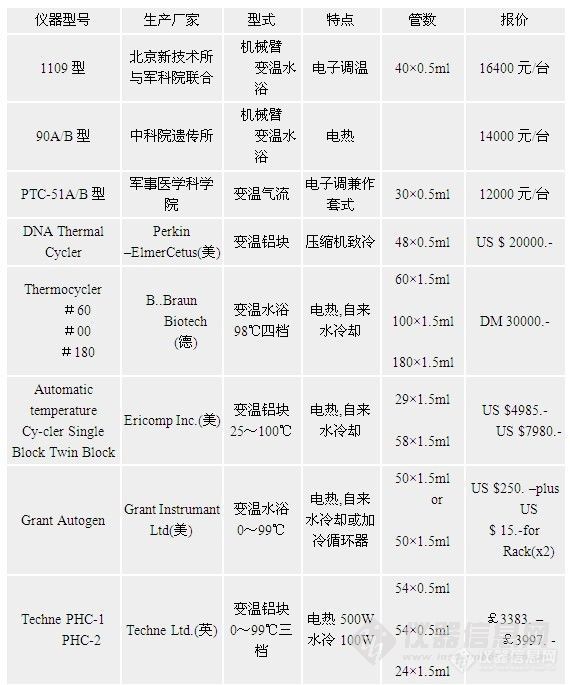
第四节 影响PCR的主要因素
PCR技术必须有人工合成的合理引物和提取的样品DNA,然后才进行自动热循环,最后进行产物鉴定与分析。引物设计与合成目前只能在少数技术力量较强的研究院、所进行,临床应用只需购买PCR检测试剂盒就可开展工作,PCR自动热循环中影响因素很多,对不同的DNA样品,PCR反应中各种成份加入量和温度循环参数均不一致。现将几种主要影响因素介绍如下。 一、温度循环参数 在PCR自动热循环中,最关键的因素是变性与退火的温度。如操作范例所示,其变性、退火、延伸的条件是:94℃60s, 37℃60s, 72℃120s,共25~30个循环,扩增片段500bp。在这里,每一步的时间应从反应混合液达到所要求的温度后开始计算。在自动热循环仪内由混合液原温度变至所要求温度的时间需要30~60s,这一迟滞时间的长短取决于几个因素,包括反应管类型、壁厚、反应混合液体积、热源(水浴或加热块)以及两步骤间的温度差,在设置热循环时应充分给以重视和考虑,对每一仪器均应进行实测。 关于热循环时间的另一个重要考虑是两条引物之间的距离;距离越远,合成靶序列全长所需的时间也越长,前文给出的反应时间是按最适于合成长度500bp的靶序列拟定的。下面就各种温度的选择作一介绍。 1.模板变性温度变性温度是决定PCR反应中双链DNA解链的温度,达不到变性温度就不会产生单链DNA模板,PCR也就不会启动。变性温度低则变性不完全,DNA双链会很快复性,因而减少产量。一般取90~95℃。样品一旦到达此温度宜迅速冷却到退火温度。DNA变性只需要几秒种,时间过久没有必要;反之,在高温时间应尽量缩短,以保持Taq DNA聚合酶的活力,加入Taq DNA聚合酶后最高变性温度不宜超过95℃。 2.引物退火温度退火温度决定PCR特异性与产量;温度高特异性强,但过高则引物不能与模板牢固结合,DNA扩增效率下降;温度低产量高,但过低可造成引物与模板错配,非特异性产物增加。一般先由37℃反应条件开始,设置一系列对照反应,以确定某一特定反应的最适退火温度。也可根据引物的(G+C)%含量进行推测,把握试验的起始点,一般试验中退火温度Ta(annealing temperature)比扩增引物的融解温度TTm(melting temperature)低5℃,可按公式进行计算:Ta = Tm - 5℃= 4(G+C)+ 2(A+T) -5℃
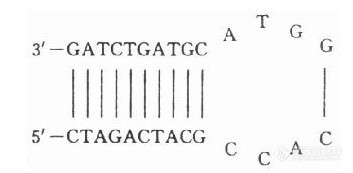
其中A,T,G,C分别表示相应碱基的个数。例如,20个碱基的引物,如果(G+C)%含量为50%时,则Ta的起点可设在55℃。在典型的引物浓度时(如0.2μmol/L),退火反应数秒即可完成,长时间退火没有必要。 3.引物延伸温度温度的选择取决于Taq DNA聚合酶的最适温度。一般取70~75℃,在72℃时酶催化核苷酸的标准速率可达35~100个核苷酸/秒。每分钟可延伸1kb的长度,其速度取决于缓冲溶液的组成、pH值、盐浓度与DNA模板的性质。扩增片段如短于150bp,则可省略延伸这一步,而成为双温循环,因Taq DNA聚合酶在退火温度下足以完成短序列的合成。对于100~300bp之间的短序列片段,采用快速、简便的双温循环是行之有效的。此时,引物延伸温度与退火温度相同。对于1kb以上的DNA片段,可根据片段长度将延伸时间控制在1~7min,与此同时,在PCR缓冲液中需加入明胶或BSA试剂,使Taq DNA聚合酶在长时间内保持良好的活性与稳定性;15%~20%的甘油有助于扩增2.5kb左右或较长DNA片段。 4.循环次数常规PCR一般为25~40个周期。一般的错误是循环次数过多,非特异性背景严重,复杂度增加。当然循环反应的次数太少,则产率偏低。所以,在保证产物得率前提下,应尽量减少循环次数。 扩增结束后,样品冷却并置4℃保存。 二、引物引物设计 要扩增模板DNA,首先要设计两条寡核苷酸引物,所谓引物,实际上就是两段与待扩增靶DNA序列互补的寡核苷酸片段,两引物间距离决定扩增片段的长度,两引物的5’端决定扩增产物的两个5’末端位置。由此可见,引物是决定PCR扩增片段长度、位置和结果的关键,引物设计也就更为重要。 引物设计的必要条件是与引物互补的靶DNA序列必须是已知的,两引物之间的序列未必清楚,这两段已知序列一般为15~20个碱基,可以用DNA合成仪合成与其对应互补的二条引物,除此之外,引物设计一般遵循的原则包括: 1.引物长度根据统计学计算,长约17个碱基的寡核苷酸序列在人的基因组中可能出现的机率的为1次。因此,引物长度一般最低不少于16个核苷酸,而最高不超过30个核苷酸,最佳长度为20~24个核苷酸。这样短的寡核苷酸在聚合反应温度(通过72℃)下不会形成稳定的杂合体。有时可在5’端添加不与模板互补的序列,如限制性酶切位点或启动因子等,以完成基因克隆和其他特殊需要;引物5’端生物素标记或荧光标记可用于微生物检测等各种目的。 有时引物不起作用,理由不明,可移动位置来解决。 2.(G+C)%含量引物的组成应均匀,尽量避免含有相同的碱基多聚体。两个引物中(G+C)%含量应尽量相似,在已知扩增片段(G+C)%含量时宜接近于待扩增片段,一般以40%~60%为佳。 3.引物内部应避免内部形成明显的次级结构,尤其是发夹结构(hairpin structures)。例如:
![]()
4.引物之间两个引物之间不应发生互补,特别是在引物3’端,即使无法避免,其3’端互补碱基也不应大于2个碱基,否则易生成“引物二聚体”或“引物二倍体”(Primer dimer)。所谓引物二聚体实质上是在DNA聚合酶作用下,一条引物在另一条引物序列上进行延伸所形成的与二条引物长度相近的双链DNA片段,是PCR常见的副产品,有时甚至成为主要产物。 另外,两条引物之间避免有同源序列,尤为连续6个以上相同碱基的寡核苷酸片段,否则两条引物会相互竞争模板的同一位点;同样,引物与待扩增靶DNA或样品DNA的其它序列也不能存在6个以上碱基的同源序列。否则,引物就会与其它位点结合,使特异扩增减少,非特异扩增增加。 5.引物3’端配对DNA聚合酶是在引物3’端添加单核苷酸,所以,引物3’端5~6个碱基与靶DNA的配对要求必须精确和严格,这样才能保证PCR有效扩增。 引物设计是否合理可用PCRDESN软件和美国PRIMER软件进行计算机检索来核定。 人工合成的寡核苷酸引于最好经过色谱(层析)纯化或PAGE纯化,以除去未能合成至全长的短链等杂质。纯化引物在25%乙腈溶液中4℃保存可阻止微生物的生长;一般情况下,不用的引物应保存在-20℃冰箱中,在液体中引物能保存6个月,冻干后可保存1~2年。 三、DNA聚合酶 早在1956年Kornberg等就从大肠杆菌提取液中发现了DNA聚合酶,并且得到了DNA聚合酶Ⅰ纯品。DNA聚合酶Ⅰ是由分子量为109000的一条多肽链构成,此酶可被枯草杆菌蛋白酶分解为两个片段,一个片段分子量为76000,有聚合酶活性,并有3’→5外切酶活力,即Klenow片段(Klenow fragment)。另一个片段分子量为34000,具有5’→’3’外切酶活力。因此,DNA聚合酶具有几种功能:一是聚合作用,以DNA为模板,将dNTP中的脱氧单核苷酸逐个加到3-OH末端。二是有’3’→5’外切酶活力,能识别和消除错配的引物末端,与复制过程中校正功能有关。三是5’→3’外切酶活力,它能从5’端水解核苷酸,还能经过几个核苷酸起作用,切除错配的核苷酸。1985年Mullis 等发明了PCR方法,以Klenow片段完成β-珠蛋白的PCR后,世界上许多实验室就考虑用耐热DNA聚合酶代替Klenow片段进行PCR,使耐热多聚酶的研究得以迅速发展。人们从生活于60℃(B.Stearothermophilus)到87℃(S.Solfatavicus)的许多菌中分离纯化出耐热DNA聚合酶,但有些酶不能耐受DNA变性所需温度,所以无法应用于PCR。现就PCR反应中常用的DNA聚合酶等作一详细介绍。 1.Taq DNA聚合酶用Taq DNA聚合酶代替大肠杆菌DNA聚合酶Ⅰ的Klenow片段是使PCR普及应用的关键。Klenow片段不能耐受95℃的双链DNA变性温度,所以每次循环都要加入新酶;而Taq DNA聚合酶可以耐受93~95℃的高温,避免了不断补加多聚酶的繁琐操作,同时使退火和延伸温度得以提高,减少了非特异性产物和DNA二级结构对PCR的干扰,增进了PCR特异性、产量和敏感度,二者相比,其主要区别在于:①Klenow酶的最适温度为37℃,扩增的产物并非全是目的序列,需用探针检测。Taq酶则不仅产率高而特异性也高。它的最适温度为74~75℃。因而使退火温度可以提高,使退火严格性提高,减少错配引物的延伸。②循环后期酶量渐感不足而产生平坡。到达平玻的循环次数,Klenow酶为20个(均用1μg基因组DNA开始)而Taq酶为30个。③延伸片段长度Taq酶为10kb以内,而Klenow酶为400bp以内。 Taq酶由水栖高温菌(Thermus aquatics)YT1蓖株中分离而得。此菌于1969年由Brock分离自美国黄石公园温泉,作为栖热杆菌的标准菌株,其生长温度为70~75℃。最初从中分离到分子量60~68KDa,比活性为2000~8000U/mg的DNA聚合酶。后来Cetus公司的Kary Mullis等又分离到比活为20万U/mg的纯酶,分子量为93910。此种9.4KDa酶的最适温度为75~80℃,与单纯核苷酸的结合率(Kcat)可达150核苷酸(nt)/s酶分子。以M13模板,用富含G+C的30bp引物延伸,70℃时Kact>60nt/s;55℃可达24nt/s;37℃时为1.5nt/s,而22℃时低至0.25nt/s。高于90℃时DNA合成活性甚差,这种高温条件下,引物与模板已不能牢固结合。 在PCR反应混合液中,Taq酶于92.5℃,95℃及97.5℃保持其50%活力的时间分别为130、40及5~6min,在50次循环的PCR中当管内最高温度为95℃。每循环为20s时尚可保持65%活力。Taq 酶在95℃的半寿期为40min,故在PCR循环中选用的变性温度,不宜高于95℃。 Taq酶现已可用基因重组的方法生产,商品名为Ampli Taq(Cetus公司)。Taq酶的完整基因长2499bp,在大肠杆菌中表达生产,含832个氨基酸。在氨基酸序列上与大肠杆菌DNA聚合酶Ⅰ有38%是一致的,包括对dNTP结合,引物与模板作用区均存在于Taq酶中。 Taq酶具有依赖DNA合成的5’→’3’外切酶活性,因此,模板上有一段退火的3’-磷酸化的“阻断物”,会被逐个切除而不会阻止来自上游引物链的延伸,而对于5’-32P标记的合成寡核苷酸引物,则无论是单链或是与模板复性,都未发现降解,所以该种活性不会影响PCR结果。Taq酶没有3’→’5’外切酶活性,如果发生dNTP错误掺入,这种酶没有校正能力,因此运用Taq酶进行PCR,产物中点突变较多,对克隆等不太有利。一般错掺率为1.25×10-4~1×10-5(4×dNTPs浓度分别为200μmol/L,Mg2+为1.5mmol/L,在55℃退火)。但不含3’→5’外切酶活性对测序有利。 2.影响酶活力的因素Taq酶的活力受Mg2+离子的影响。用鲱精DNA为模板,总dNTP浓度0.7~0.8mmol/L,Mg2+为2.0mmol/L时激活能力最高。浓度超过此值产生抑制。10mmol/l MgCl2抑制活力达40%~50%。dNTP能与Mg2+结合,故游离Mg2+只是结合后剩余的量。若总dNTP浓度高至4~6mmol/L时,Taq酶活力要降低20~30%,即底物抑制。 dNTP浓度低时PCR产率及特异性均增高,适合于用扩增掺入法标记生物素及放射性元素。当100μl PCR液中含dNTP各40μmol/L时就足以合成2.6μg的DNA(dNTP消耗一半)。表22-3 有机溶剂对Taq聚合酶活力的影响
![middle]() 用鲱精DNA,70℃,10min内dNTP的掺入量计算,标准条件为100%。 纯9.4KDa Taq酶不含3’→5’核酸外切酶活力。误掺入率取决于dNTP浓度。但Taq酶具有DNA依赖的链移位5’→3’核酸外切酶活力。对5’→3’32P标记寡核苷酸单链,或与MB模板杂交时均只有极少的降解力。 中等浓度KCl能刺激Taq酶合成活力达50%~60%,最佳KCl浓度为50mmol/L,浓度更高有抑制作用,>200mmol/L的KCl可使酶失活。 加入50mmol/L NH4Cl或NH4Ac或NaCl,可产生中度抑制或无作用。 低浓度尿素、DMSO、DMF或甲酰胺影响不大,吐温20/NP40可消除SDS(0.01%及0.1%)的抑制作用。 3.第二代耐热DNA聚合酶Stoffel片段:Cetus公司的Stoffel将Taq DNA聚合酶的5’→3’外切酶活性片段(N端289个氨基酸)去除,称为stoffel片段。其97.5℃的半衰期从Taq DNA聚合酶的5~6min提高到20min,同时该酶片段也对两个或更多模板位点的扩增反应即复合PCR(Multiplex PCR)更为有利。 VentTM DNA多聚酶:是美国New England Biolabs公司从潜水艇排气孔(Vent)中分离的超级嗜热菌-能生长于98℃中的Thermococcus litoralis中分离纯化得到的,故名Vent酶。它的一些酶学性质较Taq DNA聚合酶更为优越,它能耐100℃高温且2h以上仍有活力,并且具有3’→5’外切酶活性的校正能力,错误扩增的机率比Taq酶降低一倍。后来该公司又从深水潜艇(2010m)排气孔分离的能在104℃生长的Pyococcus菌GB-D株植入Deep Vent DNA聚合酶基因而表达的Deep Vent DNA聚合酶,在95℃的半寿期达23h(Vent酶为6.7h,Taq酶为1h)。 4.RTth逆转录酶(rTth Reverse Transcriptase)目前逆转录-PCR(RT-PCR)的发展很快,所以对耐热的依赖于RNA的DNA多聚酶的研究也有进展。有实验表明Taq DNA多聚酶有依赖于RNA的DNA聚合酶活性,但活性较弱。Cetus公司于1991年推出一种rTth Reverse Tran-scriptase,有很好的依赖于RNA的耐热DNA聚合酶活性和依赖于DNA的耐热DNA聚合酶活性,二种活性分别依赖于Mn2+Mg2+,这样就可分别控制酶活性。利用该酶只需250ng的总RNA即可有效地进行RT-PCR,得到特异的DNA片段,从而非常有利于逆转录PCR的发展。 耐热DNA聚合酶的研究近几年来得到长足的发展,这在PCR发展中起到了重要的作用。我们相信随着进一步的研究,将使人们对耐热DNA聚合酶的认识和应用更进一步地发展。 我国的PCR研究发展很快,其关键试剂-耐热DNA聚合酶-也已有几个实验室能够分离纯化,如复旦大学遗传学研究所、华美公司、中国医学科学院基础医学研究所。后二者的菌株为Thermus aquaticus YT-1。前者则是从自己筛选的嗜热菌中分离纯化,复旦大学遗传所亦已成功地克隆了该聚合酶的基因并获得了耐热F4DNA聚合酶,其酶学性质非常接近于Taq DNA聚合酶,为我国PCR的开展提供了保证。 四、影响PCR特异性的因素 通过上述内容。可以看出有许多因素可以影响PCR的特异性,在此我们作一归纳,供大家参考:①退火步骤的严格性:提高退火温度可以减少不匹配的杂交,从而提高特异性。②减短退火时间及延伸时间可以减少错误引发及错误延伸。③引物二聚体是最常见的副产品,降低引物及酶的浓度也可以减少错误引发,尤其是引物的二聚化。④改变MgCl2(有时KCl)浓度可以改进特异性,这可能是提高反应严格性或者对Taq酶的直接作用。⑤模板中如果存在次级结构,例如待扩增的片段易自行形成发夹结构时,可在PCR混合物中的4×dNTPs中加入7-脱氮-2’-脱氧鸟苷-5’-三磷酸(7-deaza-2’-deoxyguanosine-5’-trihosphate)(de7GTP)。用de7GTP与dGTP比例为3:1的混合物(150μmol/l de7GTP +50μmol/L dGTP)代替200μmol/l dGTP,则可阻非特异性产物的生成。 五、扩增平坡 扩增反应并不是可以无穷地进行下去的,经过一定的循环周期后需扩增的片段不再按指数增多而逐渐进入平坡;进入平坡的循环次数,取决于起始时存在的模板拷贝数以及合成的DNA总量。所谓平坡就是批PCR循环的后期,合成产物达0.3~1pmol时,由于产物的堆积,使原来以指数增加的速率变成平坦的曲线。 造成PCR进入平坡的原因有:引物和dNTP等消耗完毕、Taq酶失活,这几中因素在标准反应中均不会出现。此外,还有几种可能: 1.底物过剩 因DNA合成量多于反应液中存在的Taq酶,在100μl反应液中含2.5Utaq酶而DNA合成量达1μg(3nmol脱氧核苷酸)时,开始变为底物过剩。延长延伸时间或添加Taq酶,可以克服之。但不实用,因每进行下一循环就要延长延伸时间一倍及多加一倍Taq酶,才能继续保持指数增长。 2.非特异性扩增产物的竞争 与上述情况密切相关,此时不需要的DNA片段与需要的片段同时竞争聚合酶,要克服这一情况是要提高反应特异性,使不需要片段不能大量积聚。 3.退火时产物的单链自己缔合 两条单链的DNA片段在退火时除了与引物缔合外,也可以自行缔合,这也会阻止产品增多。当产物浓度到达10pmol/100μl时即可发生此现象,除稀释外无法克服。 4.变性在高浓度产物条件下,产物解链不完全,以及最终产物的阻化作用(焦磷酸化,双链DNA)。 总而言之,PCR的条件是随系统的而异的,并无统一的最佳条件,先选用通用的条件扩增,然后稍稍改变各参数,可以达到优化,以取得优良的特异性和产率。
用鲱精DNA,70℃,10min内dNTP的掺入量计算,标准条件为100%。 纯9.4KDa Taq酶不含3’→5’核酸外切酶活力。误掺入率取决于dNTP浓度。但Taq酶具有DNA依赖的链移位5’→3’核酸外切酶活力。对5’→3’32P标记寡核苷酸单链,或与MB模板杂交时均只有极少的降解力。 中等浓度KCl能刺激Taq酶合成活力达50%~60%,最佳KCl浓度为50mmol/L,浓度更高有抑制作用,>200mmol/L的KCl可使酶失活。 加入50mmol/L NH4Cl或NH4Ac或NaCl,可产生中度抑制或无作用。 低浓度尿素、DMSO、DMF或甲酰胺影响不大,吐温20/NP40可消除SDS(0.01%及0.1%)的抑制作用。 3.第二代耐热DNA聚合酶Stoffel片段:Cetus公司的Stoffel将Taq DNA聚合酶的5’→3’外切酶活性片段(N端289个氨基酸)去除,称为stoffel片段。其97.5℃的半衰期从Taq DNA聚合酶的5~6min提高到20min,同时该酶片段也对两个或更多模板位点的扩增反应即复合PCR(Multiplex PCR)更为有利。 VentTM DNA多聚酶:是美国New England Biolabs公司从潜水艇排气孔(Vent)中分离的超级嗜热菌-能生长于98℃中的Thermococcus litoralis中分离纯化得到的,故名Vent酶。它的一些酶学性质较Taq DNA聚合酶更为优越,它能耐100℃高温且2h以上仍有活力,并且具有3’→5’外切酶活性的校正能力,错误扩增的机率比Taq酶降低一倍。后来该公司又从深水潜艇(2010m)排气孔分离的能在104℃生长的Pyococcus菌GB-D株植入Deep Vent DNA聚合酶基因而表达的Deep Vent DNA聚合酶,在95℃的半寿期达23h(Vent酶为6.7h,Taq酶为1h)。 4.RTth逆转录酶(rTth Reverse Transcriptase)目前逆转录-PCR(RT-PCR)的发展很快,所以对耐热的依赖于RNA的DNA多聚酶的研究也有进展。有实验表明Taq DNA多聚酶有依赖于RNA的DNA聚合酶活性,但活性较弱。Cetus公司于1991年推出一种rTth Reverse Tran-scriptase,有很好的依赖于RNA的耐热DNA聚合酶活性和依赖于DNA的耐热DNA聚合酶活性,二种活性分别依赖于Mn2+Mg2+,这样就可分别控制酶活性。利用该酶只需250ng的总RNA即可有效地进行RT-PCR,得到特异的DNA片段,从而非常有利于逆转录PCR的发展。 耐热DNA聚合酶的研究近几年来得到长足的发展,这在PCR发展中起到了重要的作用。我们相信随着进一步的研究,将使人们对耐热DNA聚合酶的认识和应用更进一步地发展。 我国的PCR研究发展很快,其关键试剂-耐热DNA聚合酶-也已有几个实验室能够分离纯化,如复旦大学遗传学研究所、华美公司、中国医学科学院基础医学研究所。后二者的菌株为Thermus aquaticus YT-1。前者则是从自己筛选的嗜热菌中分离纯化,复旦大学遗传所亦已成功地克隆了该聚合酶的基因并获得了耐热F4DNA聚合酶,其酶学性质非常接近于Taq DNA聚合酶,为我国PCR的开展提供了保证。 四、影响PCR特异性的因素 通过上述内容。可以看出有许多因素可以影响PCR的特异性,在此我们作一归纳,供大家参考:①退火步骤的严格性:提高退火温度可以减少不匹配的杂交,从而提高特异性。②减短退火时间及延伸时间可以减少错误引发及错误延伸。③引物二聚体是最常见的副产品,降低引物及酶的浓度也可以减少错误引发,尤其是引物的二聚化。④改变MgCl2(有时KCl)浓度可以改进特异性,这可能是提高反应严格性或者对Taq酶的直接作用。⑤模板中如果存在次级结构,例如待扩增的片段易自行形成发夹结构时,可在PCR混合物中的4×dNTPs中加入7-脱氮-2’-脱氧鸟苷-5’-三磷酸(7-deaza-2’-deoxyguanosine-5’-trihosphate)(de7GTP)。用de7GTP与dGTP比例为3:1的混合物(150μmol/l de7GTP +50μmol/L dGTP)代替200μmol/l dGTP,则可阻非特异性产物的生成。 五、扩增平坡 扩增反应并不是可以无穷地进行下去的,经过一定的循环周期后需扩增的片段不再按指数增多而逐渐进入平坡;进入平坡的循环次数,取决于起始时存在的模板拷贝数以及合成的DNA总量。所谓平坡就是批PCR循环的后期,合成产物达0.3~1pmol时,由于产物的堆积,使原来以指数增加的速率变成平坦的曲线。 造成PCR进入平坡的原因有:引物和dNTP等消耗完毕、Taq酶失活,这几中因素在标准反应中均不会出现。此外,还有几种可能: 1.底物过剩 因DNA合成量多于反应液中存在的Taq酶,在100μl反应液中含2.5Utaq酶而DNA合成量达1μg(3nmol脱氧核苷酸)时,开始变为底物过剩。延长延伸时间或添加Taq酶,可以克服之。但不实用,因每进行下一循环就要延长延伸时间一倍及多加一倍Taq酶,才能继续保持指数增长。 2.非特异性扩增产物的竞争 与上述情况密切相关,此时不需要的DNA片段与需要的片段同时竞争聚合酶,要克服这一情况是要提高反应特异性,使不需要片段不能大量积聚。 3.退火时产物的单链自己缔合 两条单链的DNA片段在退火时除了与引物缔合外,也可以自行缔合,这也会阻止产品增多。当产物浓度到达10pmol/100μl时即可发生此现象,除稀释外无法克服。 4.变性在高浓度产物条件下,产物解链不完全,以及最终产物的阻化作用(焦磷酸化,双链DNA)。 总而言之,PCR的条件是随系统的而异的,并无统一的最佳条件,先选用通用的条件扩增,然后稍稍改变各参数,可以达到优化,以取得优良的特异性和产率。