仲丁胺简介杨磊2021年7月21日摘要
仲丁胺(Sec-Butylamine)是一种保护性杀菌剂,对多种真菌有抑菌、抗菌活性,广泛应用于水果、蔬菜的贮藏期防腐保鲜。市售的保鲜剂如克霉灵、保果灵、桔腐净等,其主要有效成分为仲丁胺。2-AB对柑桔采后病害有着有效而广泛的作用,同时对苹果、梨、桃、香蕉的采后腐烂也有同样的控制作用。在绿色食品生产上,农业行业标准NY/T392-2013《绿色食品食品添加剂使用准则》要求不应使用仲丁胺,NY/T844-2010《绿色食品温带水果》要求仲丁胺不得检出。GB2760-2011《食品安全国家标准食品添加剂使用标准》中对仲丁胺的限量为鲜水果柑橘≤0.005mg/kg,荔枝≤0.009mg/kg,苹果≤0.001mg/kg;新鲜蔬菜(仅限蒜薹和青椒)≤3mg/kg,更新后GB2760-2014《食品安全国家标准食品添加剂使用标准》将仲丁胺从添加剂中删除,意味着仲丁胺为非法添加剂。之后GB-2019又将仲丁胺加入。
关键词:仲丁胺,添加剂,防腐。
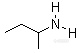
一、仲丁胺概述1.仲丁胺的简介仲丁胺(2-aminobutane,简称2-AB),又名2-氨基丁烷,是一种保护性杀菌剂,对多种真菌有抗菌活性,广泛应用于柑桔、苹果、梨、桃、香蕉、马铃薯、青椒等果品蔬菜贮藏期的防腐保鲜。也是一种具有氨臭味的无色易挥发的液体,能与水和多种有机溶剂混溶。它的分子中含有一个不对称的碳原子,因而具有两种旋光异构体。
仲丁胺的结构性质:
仲丁胺,是一种有氨臭的无色液体,溶于水、乙醇、乙醚、丙酮,熔点-104.5℃、沸点:62.5℃,主要用于有机合成的中站体、化学试剂,属于易燃物品。![]() 2.仲丁胺的发现:
2.仲丁胺的发现:1962年,美国Eckert博士首次发现2-AB处理对柑桔由Penicilliumdigitatum引起的腐烂有较好的的控制作用。1963年,Eekert等人进一步研究了21种挥发性低级脂肪胺(C2-C10)对柑桔由Penicilliumdigitatum引起的腐烂的控制作用,发现2-AB的防腐效果最好(EckertJ..W&KolbezenM.J.,1963)。1964年Eekert等人用2-AB的磷酸盐对31种病原微生物,包括半知菌类、子囊菌和藻状菌纲的真菌以及细菌进行了抑菌实验,发现有7种病原真菌对2-AB磷酸盐敏感,2-BA浓度为50-100μg/ml时,即可阻止菌丝生长达50%;有5种真菌比较敏感,2-AB浓度为250μg/ml时,可阻止菌丝生长达50%;细菌对2-AB磷酸盐不敏感,同时还发现2-AB盐酸盐、硫酸盐、磷酸盐、醋酸盐、丙酸盐和柠檬酸盐的效果无明显差异。结合防腐试验确认应用2-AB中性盐可以有效地控制8种病原真菌引起的果蔬采后腐烂。这八种病原真菌分别是Penicilliumdigitatum(指状青霉,柑桔绿霉)、Penicilliumexpansum(扩张青霉,苹果青霉)、Penicilliumitdicum(意大利青霉,柑桔青霉),它们属于青霉属真菌,主要危害柑桔、苹果、梨、葡萄等,引起青绿霉病。Monilinafructicola属于串孢盘菌属真菌,核果褐腐菌,主要危害桃、李等,引起褐腐;Glomerellafructicola属于小丛壳属真菌,炭疽病菌,主要危害柑桔、苹果、梨、山碴、桃、葡萄、柿和番茄等果实,产生褐色腐烂斑;Gloeospriummusarum盘长孢属真菌,主要危害香蕉,引起炭疽病;Phomopsiscitri拟茎点属真菌,主要危害柑桔,引起果实褐色蒂腐;Thielaviopsisparadoxa拟黑根霉属真菌,危害香蕉和菠萝,分别引起果柄腐烂和黑腐(EekertJ..W&KolbezenM.J.,1964)。此外,Scooft(1967)报道,0.05~2%的2-AB浸果处理几乎能完全控制Gloeospriummusarum对香蕉的危害。McDonnell(1971)报道,5mg/ml2-AB可有效控制Nectria(丛赤壳属真菌)引起的苹果采后腐烂。Boyd(1975)报道,用2-AB熏蒸马铃薯,对Helminthosporium(长蠕抱霉属真菌)引起的银粗皮病也有效(叶凤阁与张忠源,1991)。
3.仲丁胺的限量:在1975年FAO/WHO联合会议上,暂时人体ADI值规定为0.2mg/kg,并同时规定了在柑桔和柑桔制品中2-AB的最大残留量:干制柑桔果肉及糖蜜为50mg/kg,柑桔果实为30mg/kg,柑桔果汁为0.5mg/kg。在1975年发表的FAO/WHO专题文章里,明确指出2-AB对柑桔采后病害有着有效而广泛的作用,同时对苹果、梨、桃、香蕉的采后腐烂也有同样的控制作用。当时英国大部分马铃薯种植区采用的种薯来自苏格兰地区,在那里最严重的组织病害是由Phomaexiguavar.foveata引起的坏疽和由Oosporapustulans引起的组织斑点病害。这两种真菌能够长期潜伏在组织内部,不容易被发现,且很难控制。最常用的控制方法就是将马铃薯组织浸在有机汞消毒剂溶液中以控制大部分的病原体和坏疽,但是使用这种毒性极高的溶液,操作上存在很大的困难。研究表明当2-AB的使用量为200mg/kg马铃薯组织时,处理30-40min就能有效的控制这两种病害,因此2-AB首先在欧洲得到广泛应用。我国自从1976年河北农业大学首次合成这种防腐保鲜剂以来,全国许多单位相继开始应用2-AB对采后果蔬进行防腐保鲜处理。除上述果品蔬菜外,还对龙眼,葡萄,蒜苔,西红柿及青椒等进行了防腐效果测试,均得到了令人满意的效果。为此,相继研制开发出应用于不同果蔬的2-AB系列制剂,其用途不断扩大,市场需要量也逐年递增,有关2-AB研究的报道也逐年增多。
二、仲丁胺的毒理学评价:1967年,Eli研究了以含有不同剂量2-AB的饲料喂养处在哺乳期的奶牛,然后检测它们的粪便、血液、牛奶、尿、肝脏、肾脏、脂肪和肌肉中的2-AB残留量,发现这些组织中的2-AB含量与饲料中2-AB的添加量有剂量关系,并且已经被吸收到了牛奶和尿液里,但在牛奶中的残留量低于饲料中添加量的1%。虽然实验组的瘦肉中2-AB残留量并没有明显高于对照组,但是在肾脏和肝脏中有明显的2-AB残留。通过分析表明:2-AB易于被吸收,并且大部分都随尿液排出,结果见表1。
![]()
1968年,Eli又设计了另一组实验,他以2-AB处理过的柑桔制成干饲料,定量喂给哺乳期的奶牛,然后测定牛奶、肌肉、肝脏、脂肪和肾脏中的2-AB含量。七头Holsetin奶牛中有三头作为对照,四头定期接受含有剂量为16mg/kg2-AB的饲料,在7d的试验期间,所有的奶牛均喂以对照饲料,实验结果见表2。
![]()
1975年,联合国粮农组织(FAO)和世界卫生组织(WHO)推荐将2-AB应用于柑桔的采后防腐保鲜,并指出对控制苹果、梨、桃及香蕉的采后病害同样有效。在制定ADI之前,经过了一系列的动物试验,证明在以下水平内不会发生毒理学反应:
鼠:35mg/kg体重(63mg醋酸盐/kg体重)。
狗:69mg/kg体重(125mg醋酸盐/kg体重)。
但由于缺乏人体的临床实验观察,只制定了对人体的临时ADI值,为.02mg/kg体重。关于2-AB有无三致(致癌、致畸、致突变)危险的问题,还需作进一步的人体新陈代谢的实验观察。
三、仲丁胺的检测果蔬中一定量的防腐剂、保鲜剂可保证贮藏期间的果蔬品质,仲丁胺作为常用的果蔬防腐剂具有一定的毒性,人们食用含有仲丁胺的食品后,仲丁胺一部分随尿排出,而另一部分会积累在肾脏中。国际上已将其对人体健康的危害列为三级,对其限量标准也在不断提升,已成为农产品进出口贸易技术壁垒的瓶颈。农业部行业标准NY/T946-2006采用薄层色谱法检测仲丁胺残留量,最低检出限量为0.672mg/kg。我国农业行业标准(NY/T844-2010)规定仲丁胺在绿色食品葡萄中不得检出(<0.7mg/kg)。因此,建立一种前处理更为简便安全,检测方法灵敏度更高的仲丁胺残留检测分析方法是非常必要的。目前,国内外关于仲丁胺的检测方法主要包括薄层色谱法(TLS)、
气相色谱法(GC)、
气相色谱-质谱法(GC-MS)、高效
液相色谱法(HPLC)、高效
液相色谱-质谱法(HP
LC-MS)等。
但TLS法检测程序复杂,灵敏度低,分离度和重现性差。GC和GC-MS法对样品前处理条件要求苛刻,重复性不理想,且GC-MS和HP
LC-MS仪器昂贵。相对于其他方法,HPLC-UV具有抗干扰能力强、分析时间较短、灵敏度高的优点。由于仲丁胺的分子量小,且结构上无生色基团用于最终检测,因此多采用柱前衍生法。常用于仲丁胺检测的衍生剂有丹酰氯(DNS-Cl)、荧光胺、2,4-二硝基氟苯(DNFB)和9-氯甲酸芴甲酯(FMOC)。这些衍生剂一般都有较强的紫外吸收基团和荧光发射基团,可与仲丁胺的NH2反应生成相应的衍生物。但有些衍生剂具有一定的缺陷,如丹酰氯(DNS-Cl)需在避光条件下衍生,且试剂本身易降解,很难定量;2,4-二硝基氟苯(DNFB)的衍生化反应时间长,衍生物的稳定性差。而9-氯甲酸芴甲酯(FMOC)在温和条件下即可与伯胺、仲胺迅速发生定量反应,衍生化产物稳定,且过量的衍生剂及其水解产物不干扰测定,是一种理想的衍生化试剂。经典的仲丁胺提取法是采用凯氏定氮法检测仲丁胺,该法操作步骤繁琐耗时、操作误差偏大、难以实现自动化。
柱前衍生/高效液相色谱法1.溶液配制:硼酸盐缓冲溶液。FMOC衍生溶液:称取25.0mgFMOC,用乙腈定容至5mL容量瓶中,浓度为5g/L,相应低浓度的衍生试剂用乙腈稀释而成。标准溶液:准确称取0.200g(精确至0.001g)仲丁胺标准品,用乙腈溶解,配成40g/L的标准储备液,在4℃下保存。用乙腈将仲丁胺标准储备液逐级稀释成0.001,0.01,0.05,0.1,1.0mg/L系列质量浓度的标准溶液。
2.样品前处理:参考农业行业标准的方法,称取均匀样品25.0g(精确至0.1g)于300mL蒸馏管中,加入35mL1mol/L的CaCl2溶液、5.0gMgO与25mL水,混合均匀。将蒸馏瓶连到自动凯氏定氮仪上进行蒸馏,蒸馏时间为8min,用装有10mL0.15mol/L的H2SO4溶液和10mL蒸馏水的烧杯接收馏出液约150mL,用0.3mol/LNaOH溶液将蒸馏液调至pH7.0,最后用超纯水定容至200mL备用。
3.衍生化方法:
准确吸取标准溶液或样品0.2mL,加入0.3mL0.5g/L衍生试剂及0.3mL0.3mol/L硼酸盐溶液(pH8.0),用乙腈定容至1mL,涡旋振荡1min,使其充分反应。10000r/min离心5min,上清液过滤膜供
液相色谱测定,测定应在48h内完成。
4.HLPC条件:
色谱柱:AgilentEclipseplusC18柱(250mm×4.6mm,5μm);流动相:A为H2O,B为ACN,流速:1.0mL/min;梯度洗脱程序:0~18min,10%~95%B;18~22min,95%B;22~22.1min,95%~10%B。柱温30℃;进样量10μL;紫外检测波长265nm。
5.结果讨论:
①衍生剂浓度的影响
为保证检测仲丁胺时衍生化试剂完全过量,在0.30mol/L硼酸盐缓冲溶液pH值为8.0,反应时间为15min的条件下,考察了室温下不同浓度FMOC对0.2mL0.1mg/L仲丁胺标准溶液衍生化反应的影响。分别配制0.01,0.05,0.10,0.50,1.00,2.50,5.00g/L的衍生剂,与仲丁胺标准溶液进行衍生化反应。结果显示,当衍生剂浓度为0.50g/L时,仲丁胺衍生物色谱峰的峰面积最大,衍生反应最完全,而且氨基酸衍生物的峰形良好。故选择衍生剂的最佳浓度为0.50g/L。
②硼酸盐缓冲溶液pH值的影响
选用硼砂溶液作为缓冲溶液,分别考察了0.30mol/L硼酸盐缓冲溶液的pH值(5.0,6.0,7.0,8.0,9.0,10.0,11.0)对仲丁胺衍生化反应的影响。结果表明,当硼酸盐缓冲溶液pH值为7.0,8.0,9.0时,仲丁胺衍生产物的峰面积最高且趋于平缓。同时发现当pH值分别为5.0,6.0,7.0时仲丁胺衍生产物附近会出现1个杂峰,这可能是衍生化反应在pH≤7.0(酸性)条件下会导致产物不够稳定,产生一些副产物,故实验选择硼酸盐缓冲溶液的最佳pH值为8.0。
③衍生温度与时间的影响
FMOC的衍生化反应十分迅速,且条件温和,本实验考察了不同反应温度(4,10,室温(20~30℃),40,50,60℃)下仲丁胺衍生产物的色谱行为。结果发现,在4℃或10℃下衍生化样品会析出结晶,而室温(20~30℃),40,50℃时,衍生化反应产物一致,峰面积无显著变化且不会析出晶体;当温度为60℃时,峰面积会下降,说明高温下反应更倾向于FMOC的水解,因此反应温度过高会导致产物衍生化不完全,衍生化效率降低,测定结果不准确。由于在4~50℃条件下均可以进行衍生化反应,故本方法选择室温作为衍生化反应温度。吸取0.2mL0.1mg/L仲丁胺标准溶液于离心管中,在室温下分别衍生5,10,15,20,25,30min,考察不同反应时间的影响。结果显示,10min时衍生产物的峰面积明显高于5min时衍生产物的峰面积;而10min后的衍生化反应趋于完全,色谱峰的峰面积无显著变化。综合考虑实验的平行性和重现性,选择最佳衍生化时间为15min。
④衍生产物的稳定性
按照上述优化的衍生条件衍生后进行测定,在室温下考察测定溶液的稳定性,测定时间间隔为1,6,12,24,48,96h。结果表明,在1~48h范围内,目标物峰面积的差距很小;而96h的目标物峰面积约减少4%。为保证检测的准确性,应在48h内完成实验。
⑤样品前处理方法的优化
本实验采用全自动凯氏定氮仪代替原始的玻璃蒸馏装置,解决了前处理过程繁琐耗时、操作误差大等缺点,且该装置简便、安全、蒸馏速度快。由于蒸馏时间是影响该方法回收率的主要因素,故考察了凯氏定氮仪的不同蒸馏时间对回收率的影响。结果表明,最初随着蒸馏时间的延长,仲丁胺的回收率逐渐升高,当蒸馏8min时回收率达到最高值,此后继续延长蒸馏时间,仲丁胺的回收率则有所降低。因此本实验最终选择蒸馏时间为8min。
⑥线性范围、检出限与定量下限
采用乙腈将仲丁胺标准储备液逐级稀释成浓度为0.001,0.010,0.050,0.100,1.000mg/L的系列标准溶液,按照上述方法进行衍生化反应,衍生后分别得到仲丁胺衍生物标准工作溶液。将衍生后的溶液按浓度由低到高依次进样,以仲丁胺的质量浓度(X,mg/L)为横坐标,对应峰面积(Y)为纵坐标,得到校正曲线方程为Y=32524.7X-4.2,相关系数为0.9998,结果表明,仲丁胺在0.001~1.000mg/L范围内线性关系良好。通过加标实验,在空白基质中添加标准样品,按前述方法进行测定,以3倍信噪比(S/N=3)对应的目标物浓度作为检出限(LOD),以10倍信噪比(S/N=10)对应的目标物浓度作为定量下限(LOQ),得到仲丁胺的检出限为0.1μg/kg,定量下限为0.5μg/kg。该方法的灵敏度高,可满足样品的测定要求。
⑦回收率、准确度与精密度
分别选择黄瓜、西红柿、葡萄、橙、梨等作为空白样品,进行0.001,0.01,0.1mg/kg3个浓度水平的加标回收实验,每个浓度水平平行6次,结果见表1,空白样品和加标样品的色谱图见图1。仲丁胺在5种果蔬中的加标回收率为82.4%~95.2%,相对标准偏差为1.3%~6.8%。本方法的准确度和精密度均符合残留分析要求,能够满足果蔬中仲丁胺含量的测定要求。
![]()
采用全自动凯氏定氮仪代替原有的玻璃蒸馏仪进行蒸馏提取,FMOC作为柱前衍生剂,建立了高效
液相色谱测定果蔬中仲丁胺含量的定量分析方法。由分析结果可知,本方法操作简单,灵敏度和稳定性高,检测周期短,可用于果蔬中仲丁胺的测定。
四、参考文献[1]He X H,Ji S J.Food Res.Dev.(何晓晗,纪淑娟.食品研究与开发),2004,25(4):144-146.
[2]JiSJ,HeXH,FengH.PlantProtect.(纪淑娟,何晓晗,冯辉.植物保护),2005,(4):86-87.
[3]NY/Y946-2006.Determination of sec-Butylamine Residues in Garlic Sprout Green Pepper Orangeand Grape.Agricultural Industry Standard of the People’sRepublic of China(蒜薹、青椒、柑橘、葡萄中仲丁胺残留量测定.中华人民共和国农业行业标准).
[4]NY/T844-2010.Green Food-Temperatate Fruits.Agricultural Industry Standard of the People’s Republic of China(绿色食品温带水果.中华人民共和国农业行业标准).
[5]HaoWX.Phys.Test.Chem.Anal.:Chem.Anal.(郝蔚霞.理化检验:化学分册),2012,48:46-48.
[6]HanM,HuL,YangXF,WuXP.ActaAgric.Jiangxi(韩梅,胡莉,杨晓凤,吴显平.江西农业学报),2014,26(5):98-100.
[7]ZhongJS,TangZY,YuWF.Mod.Chem.Ind.(钟九生,唐昭英,余婉凤.现代化工),2012,32(2):92-93.
[8]JiSJ,YuLJ,LiuL,BaiB,ZhouD.FoodSci.(纪淑娟,于兰洁,刘玲,白冰,周丹.食品科学),2012,33(8):211-215.
[9]ZhangYW,YangD,XieYM,LiuQS,WangX,SongH.Chin.J.Anal.Lab.(张义文,杨丹,谢永美,刘其松,王欣,宋航.分析试验室),2009,28(5):72-75.
[10]ScudamoreKA.Analyst,1980,105:1171-1175.
[11]HuJW,GaoR,CaoMJ,CaiQF,ZhangLJ,ShuWJ,LiuGM.FoodSci.(胡家伟,高榕,曹敏杰,蔡秋凤,张凌晶,苏文金,刘光明.食品科学),2014,35(8):283-288.
[12]ZhangJH,OuyangL,PengXK,XiaLX,LiH,WangH.J.Instrum.Anal.(章建辉,欧阳丽,彭新凯,夏立新,李欢,汪辉.分析测试学报),2015,34(12):1430-1433.
[13]YangHM,HangL,YangJG,ZhangXM,HuangWH,LiC,JiangXL.Chin.J.Anal.Chem.(杨华梅,杭莉,杨建国,张雪梅,黄为红,李晨,蒋晓丽.分析化学),2016,44(3):462-467.
[14]HuangDM,HuangXY,GuRR,HuiYH,TianLL,FengB,ZhangX,YuHJ.Chin.J.Chromatogr.(黄冬梅,黄宣运,顾润润,惠芸华,田良良,冯兵,张璇,于慧娟.色谱),2014,32(8):874-879.
[15]MohammadiB,TammariE,FakhriS,BahramiG.J.Chromatogr.B,2013,928:32-36.
[16]RajiM,SharkhuuA,AmadM,MerzabanJ,GehringC.J.Anal.Bioanal.Technol.,2014,5(2):1-6.
[17]ZieglerJ,AbelS.AminoAcids,2014,46:2799-2808.
[18]BrücknerH,FlassigS,KirschbaumJ.AminoAcids,2012,42:877-885.
[19]BáezME,FuentesE,EspinaMJ,EspinozaJ.J.Sep.Sci.,2014,37:3125-3132.