[上面公式的说明]:玻璃电极是膜电极的一种。膜电极具有容许某些离子而限制某些离子进出膜的表面的特性。Na2O 22 这种玻璃的结构是由固定的带负电荷的硅酸晶格组成。CaO 6 特殊玻璃 在晶格中存在较小的,但活动力较强的正离子,主要是SiO2 72 钠离子,溶液中的氢离子能进入硅酸晶格中里代替钠离子的点位,溶液中的负离子,被带负电硅酸晶格排斥,二价或多价离子也无法进入晶格。当玻璃膜泡在水中:︱ ︱H+ + M+ -OSi — —SiO- H+ + M+
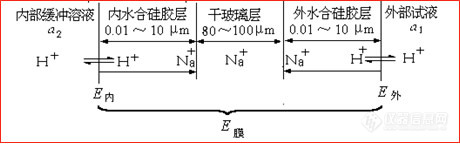
︱ ︱∵硅酸结构与H+结合的键的强度远大于Na+强度,约1014倍。反应平衡常数很大,有利于正反应,玻璃膜Na+的点位全部被H+所占据。因此会出现这样的情况: E外 E扩散 E扩散 E内
外部溶液
表面点位
被H+交换
|
点位
H+
Na+ |
Na+ |
点位
H+
Na+ |
内部溶液
表面点位
被H+交换 |
玻璃电极的膜电位包括玻璃膜和溶液之间的相界电位和玻璃膜内部的扩散电位。在理想条件下,仅仅是相界电位受pH值的影响。相界电位: 内部溶液的相界电位E内。 外部溶液的相界电位E外。相界电位产生的原因是由于在溶液中和在硅胶层中H+浓度不同引起的,扩散的结果破坏了界面附近H+原来正负电荷分布的均匀性,在两相界面形成双电层,

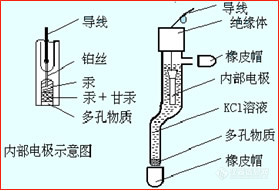
 玻璃电极
玻璃电极