维权声明:本文为qindong413原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。
血浆醇沉工艺的在线质量监测
王佳月,臧恒昌
(山东大学药学院,济南,250012)
摘要目的:在血液制品的多个生产过程中,低温乙醇沉淀法是分离纯化血液制品的重要的分离、提纯的方法之一。原料血浆沉淀作为血液制品生产环节中的上游关键环节又扮演者极其重要的角色。由于原料血浆的特殊性,很难保证批次间的重复性和一致性
。基于此,本研究将血浆醇沉过程与
近红外光谱进行有机结合,利用
近红外光谱快速无损的优点以增加对生产过程的了解,为实现生产过程的智能化制造提供了研究基础。
方法:本研究以血浆醇沉过程为研究体系,在实验室中模拟了5批正常生产过程及1批异常生产情况,讨论了NIRs对血浆醇沉过程的监测能力。通过对原始光谱的趋势分析、主成分分析(principalcomponent analysis,PCA)及多变量统计过程控制(multivariablestatistical process control,MSPC)分析,实现NIRs对血浆醇沉的过程监测。
结果:本研究说明了NIRs可以实现对血浆醇沉的过程监测,并且与离线的蛋白含量监测方法相比较更及时。从MSPC结果分析可知,采用主成分得分及HotellingT
2均可实现对异常情况的监测且监测结果较准确。
结论:本研究将NIRs分析技术引入使得该工艺自动化程度高,减少人为误差,实现对血浆醇沉过程检测的及时性且结果更准确。
关键词:近红外光谱;血浆醇沉;在线质量监控
On-linequality monitoring of plasma alcohol precipitation
Liu-xiaohui, Zang-hengchang
(Schoolof Pharmaceutical Sciences Shandong University, Jinan 250012)
Abstract Objective: Inthe production process of blood products , low temperature ethanolprecipitation method is one of the important separation and purificationmethods for separating and purifying blood products . Plasma deposition of rawmaterials is a very important role of the upstream key link in the productionprocess of blood products . Due to the particularity of raw material plasma ,it is difficult to guarantee the repeatability and consistency among lots .Based on this , this study combines the process of plasma alcohol precipitationand near infrared spectrum to increase understanding of the production process, and provides the research foundation for the intelligent manufacture of theproduction process .
Methods: In thisstudy, 5 batches of normal production and 1 batches of abnormal production weresimulated in laboratory using plasma alcohol precipitation process as theresearch system, and the ability of NIRs to monitor plasma alcoholprecipitation process was discussed. Through the trend analysis of the originalspectrum, principal component analysis, multivariable statistical processcontrol analysis and protein content analysis, the process monitoring of plasmaalcohol precipitation was realized. Test.
Results:This study shows that NIRs can monitor theprocess of plasma alcohol precipitation, and it is more timely than the offlinemethod of protein content monitoring. From the analysis of MSPC results, we cansee that the principal component score and Hotelling T2 can be used to monitorthe abnormal situation and the monitoring results are more accurate.
Conclusion: This study introduces NIRsanalysis technology to make the process automation degree high , reduce humanerror , realize the timeliness of the plasma alcohol precipitation processdetection and the result is more accurate .
Keywords: near infrared spectroscopy; plasmaalcohol precipitation;On-line quality monitoring
血浆醇沉过程是蛋白生产过程中的首要步骤,也是分离的关键步骤,其目的是为了将不同的蛋白最大程度的区分和保留,为下一步的各个蛋白的纯化和分离做准备。作为蛋白分离的首要步骤,其沉淀结果的优劣将直接影响终产品的质量和下游的分离过程。目前工业生产中的生产模式大都采用离线的方式,即通过计算固定的公式计算投料比,在反应临近终点时抽样送检。根据送检结果判定反应进行的阶段并预估沉淀终点。这种方式的缺点是其结果往往滞后于生产过程,不能对过程进行实时的监控。因此,为了更好的实现过程的控制和在线的含量监测,本实验将
近红外光谱分析技术引入到血浆中蛋白分离的过程中来,以达到准确判断沉淀终点、合理利用宝贵的血浆资源的目的。
1材料与方法
1.1主要仪器与原料
1.1.1试剂血浆(山东泰邦生物制品有限公司);无水乙醇(分析纯,国药集团化学试剂有限公司);去离子水
1.1.2仪器和软件 ![]()
1.2过程操作
1.2.1醇沉过程原料血浆在4℃条件下添加醋酸缓冲液调节血浆pH为5.95±0.05,称取此时血浆溶
液质量,根据质量计算所应添加的95%乙醇体积。
模拟生产工艺:醇沉过程在低温反应仪中进行,温度设定和实际生产反应温度一致,为-4.5℃。每个批次取100mL 血浆上清置于250mL的三颈瓶中,当温度为0℃开始加乙醇,正常批次用恒流泵添加乙醇,添加速度为0.875mL/min。醇沉开始前以及醇沉过程中每2min取样0.55mL用于蛋白含量的测定。一个批次的醇沉时间为40min,共得到42个样品,一共进行8个正常批次的醇沉过程及1个批次的异常醇沉过程。
醇沉终点的计算:本实验中采用的乙醇添加量是根据工厂的固定生产工艺摸索总结得到的。工厂中采用乙醇喷加的方式,加入固定体积的乙醇后即为反应终点。具体的计算公式如下:
需加乙醇量的体积=悬液体积×19%÷(R-19%)×0.835
注:悬液体积为开始时的血浆体积;R为原料乙醇的浓度(%);0.835为校正系数
以本实验为例,计算醇沉终点时间和乙醇添加量分别为:
乙醇量=100mL×19%÷(100%-19%)×0.835=19.5864≈19.59mL
醇沉终点时间=19.59÷0.875≈22.39min
1.2.2实验室模拟醇沉过程本研究在实验室中模拟了5批次正常醇沉过程及1批次异常醇沉过程。其中,异常批次是为了考察模型的异常监测能力,为用低温反应仪模拟了搅拌异常的情况,在10min时停止搅拌,20min时恢复。(考虑到停止搅拌后溶液浑浊程度较大,乙醇的局部浓度会引起蛋白含量的变性对蛋白含量测定结果和意义影响较大,所以在20min时恢复搅拌条件。
采用AntarisⅡ傅里叶变换
近红外光谱仪的在线光纤探头直接探入三颈瓶的其中一颈,探头需没过液面以下,用铁架台固定探头进行光谱采集。探头采用透反模式,光谱范围4000-10000cm
-1,扫描次数32次,分辨率4cm
-1,采集光谱。光谱采集设定为自动采集,反应开始前及反应结束后各采集一张光谱,反应过程中每隔一分钟得到一张光谱。每一批次反应时间为40min,共得到光谱42张。
2 在线质量监测分析
2.1样品的原始光谱
2.1.1正常批次光谱
![]()
本研究中模拟了5批正常批次的血浆醇沉过程,共210个样品光谱图,采集得到的原始光谱图如图2-1所示。由图中可得样品间的光谱间相似性很高,波段7000-10000cm
-1吸光度跨越范围广并且有明显变化趋势。由于溶液体系中滴加乙醇的量从无到有,伴随着光谱产生了较大变化。由于多批次光谱图中观察光谱的变化趋势不明显,所以任选其中一个批次进行分析。
![]()
以05批次为正常批次的代表批次进行下一步分析,其原始光谱图如图2-2所示。随着乙醇的加入,5000-4000cm
-1、6000-5000 cm
-1光谱的吸光度值有明显的下移趋势,10000-7400cm
-1有明显的上移趋势。乙醇的分子式为C
2H
6O,结构是为CH
3CH
2OH,其分子中主要含有三类氢原子,甲基氢(-CH
3)、亚甲基氢(-CH
2-)和羟基氢(-OH)。其中-OH的一级倍频吸收主要表现在650-6000cm
-1,二级倍频主要表现在7000-6600 cm
-1,组合频主要表现在4850-4750cm
-1,CH
3的一级倍频主要体现在5900-5750cm
-1,二级倍频主要表现在7300-7000、8800-8200cm
-1,CH
2的组合频主要表现在4400-4200cm
-1,一级倍频主要表现在6100-5700 cm
-1,二级倍频主要表现在7100-6800和8500-8000cm
-1。总体来说,乙醇的量是对光谱的变化的主要影响因素,乙醇基团的特征变化区域为4850-4200cm
-1、6100-5700 cm
-1、7000-6600cm
-1、8800-8000 cm
-1。
2.1.2异常批次光谱从图2-9中B图可以看出,整个形状聚集为两类不同形状的光谱图。第10-20min光谱形状与正常条件下光谱相类似但是更聚集,而第21-30min光谱整体聚集在一起,趋势变化较小且与之前相比光谱形状有较大差异。在第20min恢复搅拌后,21min出现明显的光谱形状变化,可能是由于检测的滞后性引起的。反应模拟条件为20min而不是25min恢复搅拌,主要是考虑由于停止搅拌,乙醇滴加局部过浓很有可能会导致蛋白的变性或失活,可能会对体系的产生较大的影响。
![]()
2.2 PCA分析
2.2.1主成分得分
2.2.1.1正常批次分析 与原始光谱分析方法类似一致,为了更细致的了解原始光谱变化的规律,我们随机抽取5批正常批次中的05批次进行PCA研究分析。为了去除沉淀后悬浊的蛋白颗粒对光谱的影响,将图谱用SNV预处理后进行进一步的分析。
![]()
图2-12表示的是PCA模型的RMSECV和RMSEP值随着LVs的变化情况。当LVs为3时,出现第一个明显拐点,RMSECV有较小值,因此选择3作为最佳的LVs。
![]()
如图2-13所示,A图表示PC1-PC 2之间的关系,B图表示PC1与PC3之间的关系。从图中,可以明显的观察到几个拐点,其中A图中的21点与B图中的21点都为明显的拐点,且与蛋白的沉淀终点所对应的样品点对应,推测其可能是由于蛋白沉淀造成的。由于第一、第二主成分的和为96.30%,即可以解释整体光谱的96.30%的变异,所以我们对前两个主成分进行分析以确定其各个主成分所代表的意义。
![]()
如图2-14所示,A图表示样品点与PC1之间的关系,B图表示添加的乙醇量与PC1之间的关系,C图表示总蛋白含量与PC1之间的关系。从图中可以看出,PC1得分与乙醇的加入量成一定的相关性,尤其是在生成沉淀之前,呈现相似的同一线性趋势,推测PC1得分有可能主要反应了醇沉体系中乙醇含量变化。在蛋白沉淀前,乙醇的加入量对PC1的影响较大,这可能是由于光谱采集到了大量的乙醇分子的光谱。此外,由于PC1的拐点与蛋白含量的拐点重合,20min之前PC1得分值升高,而蛋白含量基本不变;相反的,在20min拐点之后,蛋白含量不断下降而PC1值基本趋于稳定。说明PC1与体系中的蛋白含量也存在一定的相关性。
![]()
图2-15所示中,A图为样品与PC2 之间的关系图,B图为乙醇添加量与PC2之间的关系,C图为总蛋白含量与PC2之间的关系。结果显示随着醇沉时间的进行,PC2呈现“v”字形变化趋势,与乙醇添加量及总蛋白含量的总体趋势一致。1-5个点基本平稳,刚开始加入乙醇时为醇沉开始期;6-30个样品为沉淀期。其中蛋白含量与PC2呈现一致趋势,说明PC2可能主要反应总蛋白的含量;31-42个样品为沉淀结束后期,样品光谱及PC2得分趋于平稳。
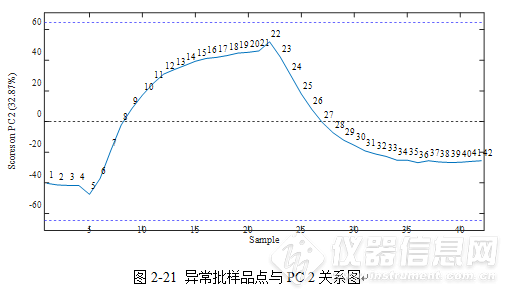
2.2.1.2异常批次分析图2-19表示的样品PC1与PC2之间的关系图,可以明显的看出10-20min PC 1点聚集在一起,恢复搅拌后21min与22min有明显的断层,这一点在图2-19、2-20、2-21中都有所显示。说明光谱发生了显著差异,体系也发生了变化。停止搅拌后,由于乙醇滴加的位置没有变化,所以乙醇滴加处乙醇含量可能局部过高。恢复搅拌的瞬间,光谱采集到的仍有可能是局部乙醇含量较高的光谱。之后随着搅拌的恢复,体系逐渐恢复稳定。
![]()
![]()
![]()
2.3 MSPC分析:MSPC中常见的统计量包括主成分得分、HotellingT
2分析和SPE统计量等。在本研究中选用了主成分中的PC1和HotellingT
2进行进一步的分析。
2.3.1主成分得分控制图主成分得分是通过多变量投影方法计算得到,但是当主成分数目过多时,会造成监控的困难。在本研究体系中,PC1解释了光谱85%的变异,代表了大部分的光谱信息,得分代表了醇沉过程中体系的变化趋势,因此建立了基于PC1得分的主成分得分控制图。首先计算了5批正常醇沉过程的PC1得分的平均值和标准差,然后计算平均值±3倍的标准差作为控制图的上下临界线。如图2-25所示,图中表示PC1对正常批次的监控图,其中红色的控制线表示±3倍标准差得到的上下控制线。由图中可以看出,随着样品取样点和取样时间的推进,PC1得分呈阶梯状,1-5min变化趋势平缓,5-22min呈线性变化趋势,23-42min沉淀后期趋势平缓。5批样品的醇沉过程的PC1得分值的变化趋势基本一致,说明批次之间的差异较小。
![]()
图2-26为异常批次的PC1得分控制图,其中红色线为上下的控制线,超出控制线视为异常情况。黄色线显示的是第10批次异常情况为第10min停止加乙醇,25min恢复的情况,从图中可以看出10批次在第11min时就超出了控制线,且PC1的得分值趋于稳定,在25min恢复后PC1值有明显的上升趋势,整体来说从10min停止乙醇后,体系的变化趋势就不在控制线内,即使恢复条件后仍超出了控制线。紫色线显示的是10min停止搅拌20min恢复的异常生产情况。从图中可以看出,异常批次在13min时超出了控制线,且PC1的得分值趋于稳定,在第20min恢复后,PC1得分值有明显的拐点,但仍超出了控制线。绿色线显示的是10min时增大流速25min时恢复的异常情况。从图中可以看出,第12批次在14min时超出了控制线,在25min恢复时,逐渐回到控制线内。
由PC得分图可知,建立的控制模型图可以有效的对醇沉过程进行监测,可以实现对过程中的异常情况监测,及时发现仪器异常故障、人为操作失误等以保证过程的正常进行。
![]()
2.3.2 Hotelling T2分析HotellingT
2图反映了每个采样点在变化趋势和幅值上偏离模型的程度。如图2-27所示,正常批次的数据的Hotelling T
2统计量都在控制限以内,红色的控制线为3批样品的HotellingT
2的均值±3倍的标准差,说明这5个批次建立的模型所解释的过程变量运行正常。
![]()
图2-27 Hotelling T2对正常批次的监控图
如2-28所示,为HotellingT
2对异常批次的监控图,其中红色线为控制线。异常批次10批、11批和12批分别在13min、14min、13min超出控制线。异常样品与其余正常生产批次样品存在明显区别,判别结果与
近红外光谱原始光谱判别结果(3.1.2)一致,说明采用HotellingT
2法对不同生产批次进行过程监控分析具有可行性。其中异常批次的生产过程在30min回到控制线以内,说明醇沉中终点可能受搅拌的影响较小,与乙醇添加量有较大的关系。
![]()
3结果与讨论本实验主要在实验室中模拟了5批正常批次及3批异常批次的生产情况,讨论了NIRs法对血浆醇沉过程的监测能力。通过对原始光谱分析、PCA分析以及MSPC分析,结果发现用NIRs可以实现对血浆醇沉的过程监测且更及时准确。
从原始近红外的光谱分析中可以观察到体系中随着乙醇的添加导致的光谱变化规律,进一步归属光谱波段的化学基团,可以推测醇沉过程中发生的主要变化,为进一步探究醇沉过程及监测在线异常情况提供了理论依据。从MSPC结果分析可知,采用主成分得分及HotellingT
2均可实现对异常情况的监测。虽然部分情况下监测的结果有滞后,但是与传统的含量监测方法相比仍有明显的优势。
参考文献
Beliën J, Forcé H. Supply chainmanagement of blood products: A literature review. EUR J OPER RES, 2012,217(1):1-16.
Cid J, Velásquez C A, Lozano M.Optimizing the blood component production process. Isbt Science, 2016,11(S1):19-25.
Jurado M, Algora M, GarciasanchezF, et al. Automated processing of whole blood units: operational value and invitro quality of final blood components.. Blood transfusion Trasfusione del sangue, 2012, 10(1):63-71.
E. J. Cohn, W. L. Hughes Jr.,and J. H. Weare. Preparation and Properties of Serum and Plasma Proteins. XIII.Crystallization of Serum Albumins from Ethanol-Water Mixtures1,J. Am. Chem.Soc., 1947, 69 (7), 1753-1761.
Oss C J V. On the mechanism ofthe cold ethanol precipitation method of plasma protein fractionation.Journal of Protein Chemistry, 1989, 8(5):661-668.
Cohn E J, Strong L E, Hughes WL, et al. Preparation and Properties of Serum and Plasma Proteins. IV. A Systemfor the Separation into Fractions of the Protein and Lipoprotein Components ofBiological Tissues and Fluids1a,b,c,d. J AM CHEM SOC, 1946, 68(3):459-475.
Farrugia A, Scaramuccia D. Thedynamics of contract plasma fractionation. Biologicals Journal of theInternational Association of Biological Standardization, 2017, 46:159.