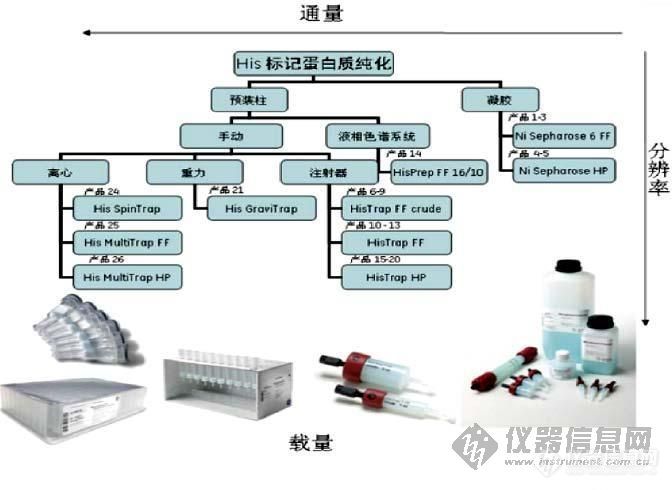
组氨酸标签蛋白的纯化
His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,无论是表达的蛋白是可溶性的或者包涵体都可以用固定金属离子亲和色谱去(IMAC)纯化。
2.1 IMAC(Immobilized Metal-ion affinity chromatography)是Porath et al.1975年用固定IDA作为配基的填料螯合过渡金属铜、镍、钴或锌离子,可以吸附纯化表面带组氨酸、色氨酸或半胱氨酸残基的蛋白,1987年Smith et al. 发现带有几个组氨酸或色氨酸小肽和螯合金属离子的IDA-sephadex G-25作用力更强,此前在1986年他和他的合作者用Ni2+-IDA-sephadex G-25亲和纯化在氨基端带组氨酸和色氨酸的胰岛素原。同年1987年Hochuli et al.发现带有相连组氨酸的多肽
多肽合成仪和Ni2+-NTA填料作用力更强于普通的肽,1988年他第一次用这样的方法纯化了带六个组氨酸标签的多肽,无论是在天然还是变性条件下一次亲和纯化都得到很好效果,此后表达带六个组氨酸标签的蛋白配合IMAC变得非常普遍,相对而言,不带标签的蛋白纯化就非常困难,所以表达带六个组氨酸标签的蛋白配合IMAC纯化变成最常用而且最有效的研究蛋白多肽合成仪结构和功能的有力手段。1986年Porath et al.还发现Fe3+-IDA-sephadex G-25可以用于磷酸化蛋白的纯化,而后发现Ga3+-IDA也有同样的效果,这样螯合这两种金属离子的填料就有效用于磷酸化多肽的富集和纯化,同时IMAC也可以用于纯化各种和金属离子结合的多肽,应用非常广泛。
市面常见的商品化IMAC用于带六个组氨酸标签蛋白的配基有以下几种:
2.2影响IMAC纯化结果的因素:
2.2.1填料的种类:
不同填料厂家的填料有差别,所以使用过程最好能得到厂家的技术支持,因为不同的厂家填料不同,此外蛋白纯化个性很强,没有哪一个填料是能适合所有带六个组氨酸标签蛋白的纯化,载量高和特异性好本身就是矛盾。
2.2.2填料的配基种类、密度、金属离子种类
填料最简单的判断是螯合好同样的金属离子,哪家产品的颜色越深就意味着和蛋白的作用力越强,适用范围越广,载量也越高,纯化的好坏关键看纯化的条件,仅有填料的特异性是不够的,同样配基密度下IDA填料的亲和力要比NTA的强,所以NTA上不能吸附的样品可以选择IDA为配基的填料。
螯合金属离子和蛋白作用强弱为铜和镍离子的强,而锌和钴离子的弱。因此如果一个蛋白作用力强,想得到好的特异性可以选择螯合钴离子,它还有一个优点是不怕还原剂,特别时候有高浓度的还原剂。相同金属离子,IDA的强于NTA。螯合金属离子的价位越低和蛋白的作用力越强。同时镍离子是最常用的,如果有条件可以换不同金属离子以得到更好的效果,因为不同的金属离子有不同的选择性。因此要希望填料应用范围广就选择镍琼脂糖凝胶,如果是希望特异性好而且稳定就选择镍NTA琼脂糖凝胶.
2.2.2蛋白本身的结构和样品来源
IMAC原理已经说明只要是带组氨酸、色氨酸或半胱氨酸残基的蛋白都可以被吸附,所以要想得到好的纯化效果,必须选择好纯化的条件,通常带组氨酸蛋白都可以在天然情况下被镍琼脂糖凝胶或镍NTA琼脂糖凝胶吸附,但是如果标签折叠在蛋白内部不容易暴露,这样就难纯化,如果镍琼脂糖凝胶都不能吸附,可以在样品和平衡缓冲液中加1-2M脲,这样蛋白结构相对松散,也许能吸附而蛋白不会变性,对于本身就是变性的蛋白如果8M脲不能吸附,改用6M盐酸胍溶解样品就可以被吸附,因为盐酸胍可以打开脲打不开的结构使得标签能暴露。当然如果有二硫键最好加1-2mMDTT也可以更好解决吸附的问题。此外也可以把标签换到另外一端。
2.2.3 缓冲体系,pH及盐浓度
对于一些作用力弱的蛋白不能选择带氮原子的的一些缓冲体系,如Tris-HCl等,适当提高缓冲液pH可以增加吸附效果,同样原理可以降低pH洗脱一些咪唑洗不去的杂带。为避免由于电荷作用的干扰,平衡缓冲液中需要加0.1-1M氯化钠,而在平衡缓冲液添加00.1-0.5%吐温或者triton可以降低由于疏水相互作用导致的非特异吸附。
2.2.4 表面活性剂及其他添加剂
添加一些表面活性剂可以增加蛋白的溶解度,降低疏水相互作用,这样使纯化的结果更好,在实验表明在平衡缓冲液中加0.5-1%的吐温可以使电泳的背景更清晰,杂带减少。对一些难溶解的样品也可以加乙醇或者甘油。在变性条件下有时会在样品中添加还原剂如巯基乙醇或者二巯基苏木糖醇,它们如果浓度过高或者上样量过大,会导致镍离子还原甚至脱落,使填料失效,如果要在这样的环境下,那最好选择螯合价位高的填料如镍NTA琼脂糖凝胶或降低还原剂的浓度,通常1-2mM是没问题的。如果一定要选择高浓度的还原剂,也可以把镍离子还成钴离子,它不怕还原,把普通的镍琼脂糖凝胶还成钴离子即可。