硫酸镁
李驰二〇二一年 7 月 28 日
一.理化性质硫酸镁,又称泄盐。无色柱状或针状细晶体,通常为针状,呈清凉咸苦味,无臭,密度2.65g/cm3。七水盐在48℃以下的潮湿空气中稳定。在温热干燥空气中易风化。48~68℃成单斜晶系六水盐MgSO4·6H2O,68℃以上成一水盐MgSO4·H2O(单斜晶系),200~300℃成白色粉末状无水物。450℃以上部分分解成MgO。可含1、2、3、4、5、6、7及12分子的结晶水。但含2、4、5分子结晶水者不稳定。极易溶于水(119.8%,20℃)及甘油,水溶液呈中性。微溶于乙醇。
二.硫酸镁的用途1.建材硫酸镁溶于水后可与轻烧粉反应形成
硫氧镁水泥。硫氧镁水泥具有较好的防火性、保温性、耐久性和环保性,应用在防火门芯板、外墙保温板、硅质改性保温板、防火板等诸多领域。
2.医药(1)硫酸镁可抑制中枢神经系统,松弛骨骼肌,具有镇静、抗痉挛以及减低颅内压等作用。常用于治疗惊厥、子痫、尿毒症、破伤风及高血压脑病等。多以10%硫酸镁10毫升深部肌肉注射或用5%葡萄糖稀释成2%~2.5%的溶液缓慢滴注。但应注意直接静脉注射或大剂量肌肉注射硫酸镁很危险,一般25%硫酸镁每次最多用15毫升即可。使用时应注意观察病人呼吸和血压情况,膝反射迟钝是镁离子足量的重要标志。
(2)镁在糖和蛋白质的代谢中有极其重要的作用。生长发育期中的儿童如果有消化不良以及应用维生素D时,应补充镁盐。
(3)镁具有许多与钾相类似的生理功能。由于镁缺乏的临床表现与缺钾相似,故缺镁往往易被忽视。在缺钾时经过补钾而症状仍无改善时,应首先考虑到缺镁的可能,这样才可使低镁血症得到及时纠正。因此,长期输液的病人,在补钾的同时要注意补镁。每日输液中加1克的硫酸镁,可防止低镁血症的发生。
(4)心功能不全的病人使用洋地黄药物时,可适当补充镁盐,防止低镁而加重洋地黄的毒性。临床上用镁盐治疗心动过速常常有效。
(5)口服硫酸镁在肠道吸收很少,因此没有上述的用途。但口服硫酸镁有良好的导泻功能,因此硫酸镁又叫泻盐。口服硫酸镁水溶液到达肠腔后,具有一定渗透压,使肠内水分不被肠壁吸收。肠内保有大量水分,能机械地刺激肠的蠕动而排便。因此硫酸镁可用于治疗便秘、肠内异常发酵;与驱虫剂并用,可使肠虫易于排出。可每次将5~20克硫酸镁溶于100~400毫升温开水中,清晨一次口服。浓度不易太高,5%为佳,否则排便延迟。
(6)硫酸镁能刺激十二指肠粘膜,反射性地引起总胆管括约肌松弛、胆囊收缩,从而促进胆囊排空,有利胆之功效。可用于治疗胆囊炎胆石症,每次2~5克,每日3次,饭前或餐间口服。50%硫酸镁稀释为33%(高浓度),5mL Tid。
(7)硫酸镁可用作消化道造影。
(8)消炎去肿:本品50%溶液外用热敷患处,有消炎祛肿的功效。
硫酸镁粉剂外敷可以消肿,用于治疗肢体外伤后肿胀、帮助改善粗糙的皮肤等。
硫酸镁易溶于水,内服不吸收,水溶液中的镁离子和硫酸根离子均不易为肠壁所吸收,使肠内渗透压升高,体液的水分向肠腔移动,使肠腔容积增加,肠壁扩张,从而刺激肠壁的传入神经末梢,反射性地引起肠蠕动增加而导泻,其作用在全部肠段,故作用快而强。作导泻剂和十二指肠引流剂。
硫酸镁静脉注射和肌肉注射主要用于抗惊厥,它可引起血管扩张,导致血压下降,由于硫酸镁的中枢抑制作用及骨骼肌松弛作用,降压作用,临床主要用于缓解子痫、破伤风等惊厥,也用于高血压危象的救治。也用作解钡盐的毒。
3.工业用于制革、炸药、肥料、造纸、瓷器、印染料、铅酸蓄电池等工业。硫酸镁和其他钾、钙、氨基酸盐、硅酸盐等矿物质一样,可以用作浴盐。
4.农业(1)肥料:在农业和园艺,硫酸镁是用来改良缺镁的土壤(镁是一个叶绿素分子的基本要素),最常见的用于盆栽植物,或含镁作物,如马铃薯,玫瑰,西红柿,辣椒和大麻。施用硫酸镁的优势超过其他硫酸镁镁
土壤改良剂(如白云质石灰)是它的高溶解性。
(2)饲料:饲料级硫酸镁作为饲料加工中镁的补充剂。镁是畜禽体内参与造骨过程和肌肉收缩时不可缺少的因子,是畜禽体内多种酶的激活剂,对畜禽体内的物质代谢和神经功能起着极其重要的作用。若畜禽机体缺镁,会导致物质代谢和神经功能紊乱,供给失调,影响畜禽生长发育,甚至导致死亡。
三.注意事项健康危害:本品粉尘对粘膜有刺激作用,长期接触可引起呼吸道炎症。误服有导泻作用,若有肾功能障碍者可致镁中毒,引起胃痛、呕吐、水泻、虚脱、呼吸困难、紫绀等。
环境危害:对环境有危害,对水体可造成污染。
燃爆危险:本品不燃,具刺激性。
其它: 该物质对环境有危害,应特别注意对水体的污染。
四.生产方式1717年有人从海水中提取得到,1868年采用硫酸镁矿制取,后来人们采用硫酸与菱镁矿等含镁矿石反应制取。早先的硫酸镁生产只有硫酸法,在上世纪70年代以前我国的高温盐浆、苦卤一直是作为废料排入大海和湖泊。这种作法,一是造成资源的严重浪费,二是造成环境的极度污染,导致海湖盐产品中杂质富集。针对这些情况,我国盐化界一直在努力研究,直到上世纪90年代,才成功地将高温盐以及苦卤中的硫酸镁提取出来,与此同时,运城盐湖苦卤生产硫酸镁的工艺也逐渐成熟。目前,硫酸镁的生产工艺主要采用硫酸法和海湖苦卤法,另外还有一些副产法,如硼镁石制取硼酸过程中的产物和生产钛白粉付产硫酸镁等。
先将硫酸和含氧化镁的矿石(白云石、菱苦土、蛇文石)或其煅烧粉(也可用氢氧化镁或碳酸镁)按比例计量,在中和罐中加入水或洗水、母液在搅拌下先徐徐加入煅烧粉等,再加入硫酸进行中和反应,控制pH=5,密度在1.370~1.384g/cm3(即39~40°Be′)范围,将中和液保持在80℃,经叶片过滤机过滤,将清液打入结晶器,冷却至30℃以下进行离心分离(可在离心机中水洗),将湿料送入振动流化床于50~55℃干燥制得七水硫酸镁。在经过高温加热即可得无水硫酸镁。
五.国家标检测方法1.范围本标准适用于以天然碳酸镁(菱镁矿)和硫酸、硫镁钒及海水为原料生产的食品添加剂硫酸镁。
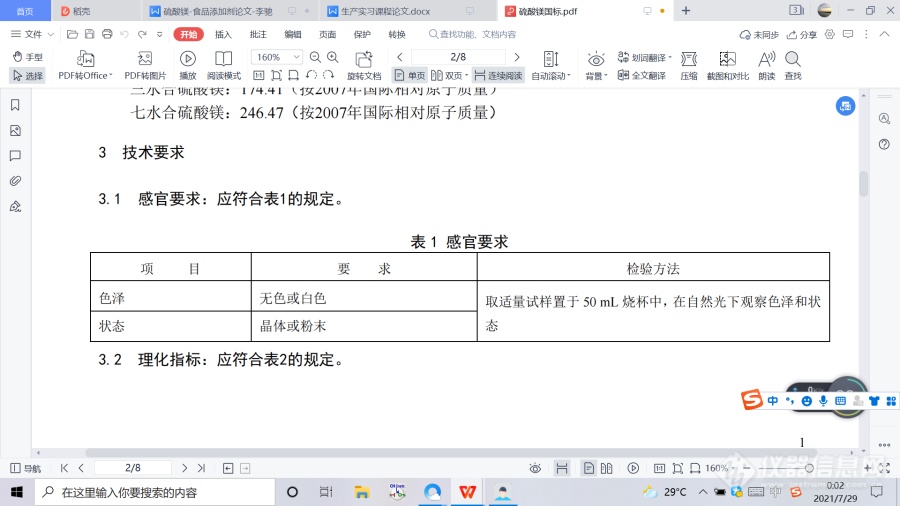
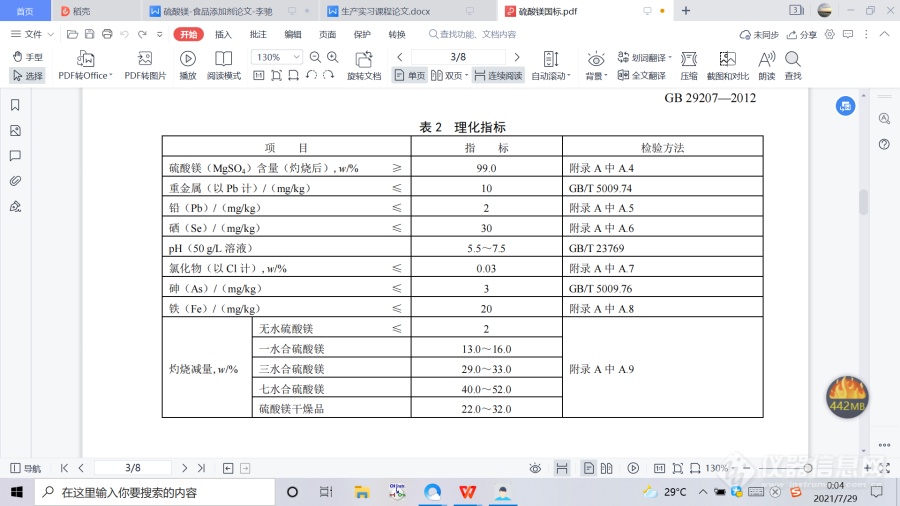
2.化学名称、分子式和相对分子质量 2.1 化学名称 无水硫酸镁 一水合硫酸镁 三水合硫酸镁 七水合硫酸镁 硫酸镁干燥品 2.2 分子式 无水硫酸镁:MgSO4 一水合硫酸镁:MgSO4·H2O 三水合硫酸镁:MgSO4·3H2O 七水合硫酸镁:MgSO4·7H2O 硫酸镁干燥品:MgSO4·nH2O(n是水合作用的平均值,在2~3之间) 2.3 相对分子质量 无水硫酸镁: 120.37(按2007年国际相对原子质量) 一水合硫酸镁:138.38(按2007年国际相对原子质量) 三水合硫酸镁:174.41(按2007年国际相对原子质量) 七水合硫酸镁:246.47(按2007年国际相对原子质量) 3.技术要求 3.1 感官要求:应符合表1的规定。 ![]() 3.2 理化指标:应符合表2的规定。
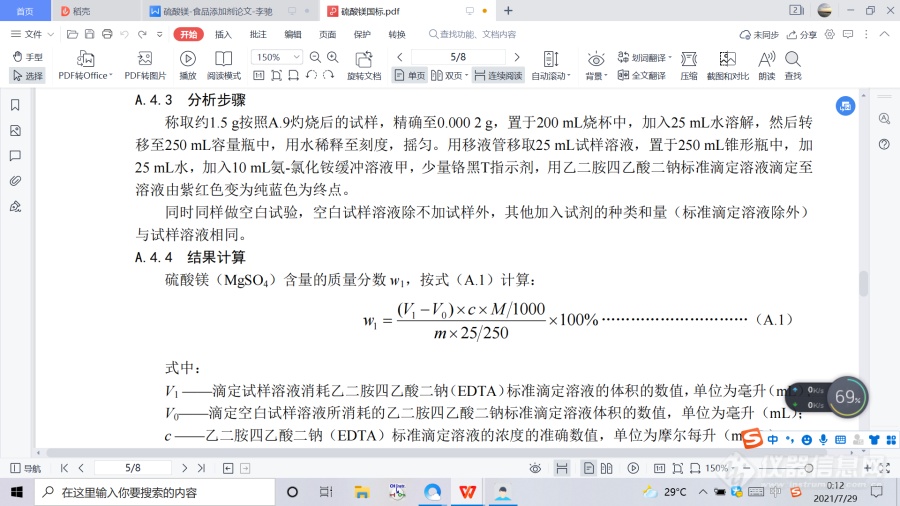
3.2 理化指标:应符合表2的规定。![]() 4.方法列表A.1 警示本标准的检验方法中使用的部分试剂具有毒性或腐蚀性,操作时应采取适当的安全和防护措施。A.2 一般规定 本标准所用试剂和水,在没有注明其他要求时,均指分析纯试剂和 GB/T 6682—2008 规定的三级水。 试验中所需标准滴定溶液、杂质测定用标准溶液、制剂和制品,在没有注明其他要求时均按 GB/T 601、GB/T 602、GB/T 603 之规定制备。所用溶液在未注明用何种溶剂配制时,均指水溶液。 A.3 鉴别试验A.3.1 试剂和材料 A.3.1.1 氯化铵溶液:200 g/L。 A.3.1.2 碳酸铵溶液:200 g/L。 A.3.1.3 磷酸钠溶液:60 g/L。 A.3.1.4 氨水溶液:2+3。 A.3.1.5 氯化钡溶液:100 g/L。 A.3.1.6 盐酸溶液:1+1。 A.3.1.7 乙酸铅溶液:80 g/L。 A.3.1.8 乙酸铵溶液:100 g/L。 A.3.2 鉴别方法 A.3.2.1 镁离子鉴别 取约 0.5 g 试样,溶于 10 mL 水,加 5 mL 氯化铵溶液、5 mL 碳酸铵溶液,搅拌,不产生沉淀,再加入 5 mL 磷酸钠溶液,产生白色结晶沉淀,加入 10 mL 氨水溶液白色结晶沉淀不溶解。 A.3.2.2 硫酸根离子鉴别 A.3.2.2.1 取约 0.5 g 试样,溶于 10 mL 水,加入氯化钡溶液,即产生白色沉淀,此白色沉淀不溶于盐酸溶液。 A.3.2.2.2 取约 0.5 g 试样,溶于 10 mL 水,加入乙酸铅溶液,即产生白色沉淀,此白色沉淀溶于乙酸铵溶液。 A.3.2.2.3 取约 0.5 g 试样,溶于 10 mL 水,加入盐酸不产生沉淀。 A.4 硫酸镁(MgSO4)含量的测定 A.4.1 方法提要 在试样溶液中加入pH≈10的氨-氯化铵缓冲溶液甲,以铬黑T为指示剂,用乙二胺四乙酸二钠(EDTA) 标准滴定溶液滴定镁含量。 A.4.2 试剂和材料 A.4.2.1 氨-氯化铵缓冲溶液甲:pH≈10。 A.4.2.2 乙二胺四乙酸二钠标准滴定溶液:c(EDTA)=0.05 mo1/L。 A.4.2.3 铬黑T指示剂。A.4.3 分析步骤 称取约1.5 g按照A.9灼烧后的试样,精确至0.000 2 g,置于200 mL烧杯中,加入25 mL水溶解,然后转移至250 mL容量瓶中,用水稀释至刻度,摇匀。用移液管移取25 mL试样溶液,置于250 mL锥形瓶中,加25 mL水,加入10 mL氨-氯化铵缓冲溶液甲,少量铬黑T指示剂,用乙二胺四乙酸二钠标准滴定溶液滴定至溶液由紫红色变为纯蓝色为终点。同时同样做空白试验,空白试样溶液除不加试样外,其他加入试剂的种类和量(标准滴定溶液除外)与试样溶液相同。 A.4.4 结果计算 硫酸镁(MgSO4)含量的质量分数 w1,按式(A.1)计算:
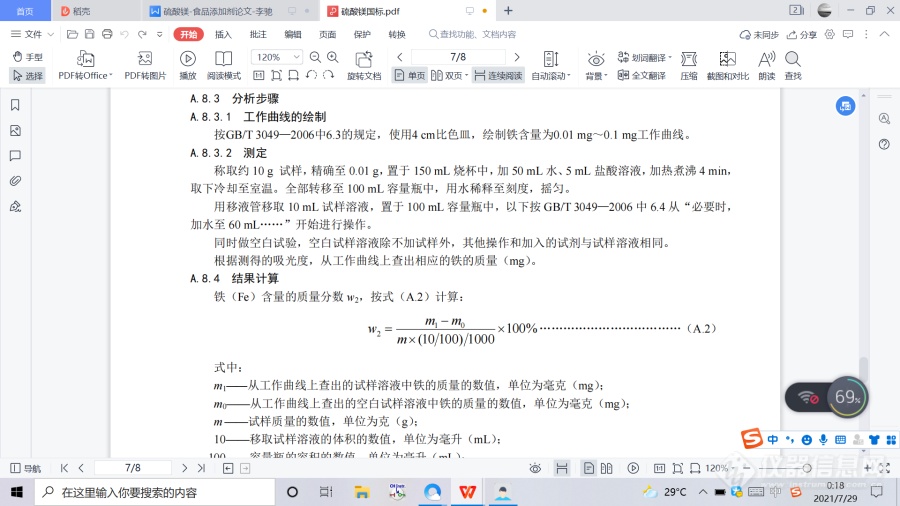
4.方法列表A.1 警示本标准的检验方法中使用的部分试剂具有毒性或腐蚀性,操作时应采取适当的安全和防护措施。A.2 一般规定 本标准所用试剂和水,在没有注明其他要求时,均指分析纯试剂和 GB/T 6682—2008 规定的三级水。 试验中所需标准滴定溶液、杂质测定用标准溶液、制剂和制品,在没有注明其他要求时均按 GB/T 601、GB/T 602、GB/T 603 之规定制备。所用溶液在未注明用何种溶剂配制时,均指水溶液。 A.3 鉴别试验A.3.1 试剂和材料 A.3.1.1 氯化铵溶液:200 g/L。 A.3.1.2 碳酸铵溶液:200 g/L。 A.3.1.3 磷酸钠溶液:60 g/L。 A.3.1.4 氨水溶液:2+3。 A.3.1.5 氯化钡溶液:100 g/L。 A.3.1.6 盐酸溶液:1+1。 A.3.1.7 乙酸铅溶液:80 g/L。 A.3.1.8 乙酸铵溶液:100 g/L。 A.3.2 鉴别方法 A.3.2.1 镁离子鉴别 取约 0.5 g 试样,溶于 10 mL 水,加 5 mL 氯化铵溶液、5 mL 碳酸铵溶液,搅拌,不产生沉淀,再加入 5 mL 磷酸钠溶液,产生白色结晶沉淀,加入 10 mL 氨水溶液白色结晶沉淀不溶解。 A.3.2.2 硫酸根离子鉴别 A.3.2.2.1 取约 0.5 g 试样,溶于 10 mL 水,加入氯化钡溶液,即产生白色沉淀,此白色沉淀不溶于盐酸溶液。 A.3.2.2.2 取约 0.5 g 试样,溶于 10 mL 水,加入乙酸铅溶液,即产生白色沉淀,此白色沉淀溶于乙酸铵溶液。 A.3.2.2.3 取约 0.5 g 试样,溶于 10 mL 水,加入盐酸不产生沉淀。 A.4 硫酸镁(MgSO4)含量的测定 A.4.1 方法提要 在试样溶液中加入pH≈10的氨-氯化铵缓冲溶液甲,以铬黑T为指示剂,用乙二胺四乙酸二钠(EDTA) 标准滴定溶液滴定镁含量。 A.4.2 试剂和材料 A.4.2.1 氨-氯化铵缓冲溶液甲:pH≈10。 A.4.2.2 乙二胺四乙酸二钠标准滴定溶液:c(EDTA)=0.05 mo1/L。 A.4.2.3 铬黑T指示剂。A.4.3 分析步骤 称取约1.5 g按照A.9灼烧后的试样,精确至0.000 2 g,置于200 mL烧杯中,加入25 mL水溶解,然后转移至250 mL容量瓶中,用水稀释至刻度,摇匀。用移液管移取25 mL试样溶液,置于250 mL锥形瓶中,加25 mL水,加入10 mL氨-氯化铵缓冲溶液甲,少量铬黑T指示剂,用乙二胺四乙酸二钠标准滴定溶液滴定至溶液由紫红色变为纯蓝色为终点。同时同样做空白试验,空白试样溶液除不加试样外,其他加入试剂的种类和量(标准滴定溶液除外)与试样溶液相同。 A.4.4 结果计算 硫酸镁(MgSO4)含量的质量分数 w1,按式(A.1)计算: ![]() 式中: V1 ——滴定试样溶液消耗乙二胺四乙酸二钠(EDTA)标准滴定溶液的体积的数值,单位为毫升(mL); V0——滴定空白试样溶液所消耗的乙二胺四乙酸二钠标准滴定溶液体积的数值,单位为毫升(mL); c ——乙二胺四乙酸二钠(EDTA)标准滴定溶液的浓度的准确数值,单位为摩尔每升(mol/L); m——试样的质量的数值,单位为克(g); M——硫酸镁(MgSO4)的摩尔质量的数值,单位为克每摩尔(g/mol)(M=120.37); 25——移取试样溶液体积的数值,单位为毫升(mL); 250——容量瓶的容积的数值,单位为毫升(mL); 1000——换算因子。 实验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于 0.2%。 A.5 铅(Pb)的测定 A.5.1 试剂和材料 A.5.1.1 三氯甲烷。 A.5.1.2 盐酸。 A.5.1.3 硝酸。 A.5.1.4 氢氧化钠溶液:250 g/L。 A.5.1.5 吡咯烷二硫代甲酸铵(APDC)溶液:20 g/L。使用前过滤。 A.5.1.6 铅(Pb)标准溶液:0.005 mg/mL。 A.5.1.7 水:符合GB6682—2008中二级水的规定。 A.5.2 仪器和设备原子吸收分光光度计:配有铅空心阴极灯。 A.5.3 分析步骤 A.5.3.1 玻璃仪器的清洗 均以硝酸溶液(1+5)浸泡过夜,用自来水反复冲洗,最后用水冲洗干净。 A.5.3.2 试样溶液的制备称取约 5 g 试样,精确至 0.01 g,置于 150 mL 烧杯中,加 30 mL 水,加入 1 mL 盐酸。加热煮沸几分钟,冷却,用水稀释至 100 mL。用氢氧化钠溶液调整溶液 pH 为 1.0~1.5。将此溶液转移至 250 mL 分液漏斗中,用水稀释至约 200 mL。加 2 mL 吡咯烷二硫代氨基甲酸铵(APDC)溶液,混合。分别用 20 mL 三氯甲烷萃取两次,收集萃取物于 50 mL 烧杯中,蒸汽浴蒸发至干(此操作必须在通风橱中进行),于残渣中加入 3 mL 硝酸,继续蒸发至近干。加入 0.5 mL 硝酸和 10 mL 水,加热直至溶液体积约 3 mL~5 mL。转移至 10 mL 容量瓶,用水稀释至刻度,摇匀。A.5.3.3 空白试样溶液的制备取 30 mL 水置于 150 mL 烧杯中,加入 1 mL 盐酸。以下操作同 A.5.3.2 中“加热煮沸几分钟,冷却,用水稀释至 100 mL??转移至 10 mL 容量瓶,用水稀释至刻度,摇匀”。A.5.3.4 标准溶液的制备移取 2.00 mL 铅标准溶液置于 150 mL 烧杯中, 加入 1 mL 盐酸。以下操作同 A.5.3.2 中“加热煮沸几分钟,冷却,用水稀释至 100 mL??转移至 10 mL 容量瓶,用水稀释至刻度,摇匀”。A.5.3.5 分析步骤将试样溶液、标准溶液导入原子吸收分光光度计中,于波长 283.3 nm 处,用空气-乙炔火焰,以空白试样溶液调零,测量吸光度。试样溶液的吸收值不应高于标准溶液吸收值。A.6 硒(Se)的测定A.6.1 试剂和材料A.6.1.1 盐酸羟胺。A.6.1.2 环己烷。A.6.1.3 盐酸溶液:1+1。A.6.1.4 氨水溶液:1+1。A.6.1.5 2,3-二氨基萘溶液:称取0.1 g 2,3-二氨基萘和0.5 g盐酸羟胺,溶解在0.1 mol/L的盐酸溶液中,制成100 mL溶液。A.6.1.6 硒(Se)标准溶液:0.01 mg/mL。A.6.2 仪器和设备分光光度计,配有光程为1 cm的比色皿。A.6.3 分析步骤称取约1 g试样,精确至0.000 2 g,置于150 mL烧杯中,加25 mL水,5 mL盐酸溶液,搅拌,加热煮沸15 min,冷却。用氨水溶液调节pH为2±0.2(用精密pH试纸检查),加入0.2 g盐酸羟胺,搅拌至溶解,立即加入5 mL 2,3-二氨基萘溶液,混匀。盖上表面皿,在室温下静置100 min。然后全部转移至125 mL分液漏斗中,补加水至约60 mL。用移液管加10 mL环己烷,用力振荡2 min,静置分层后,弃去水层。用1 cm的比色管,在波长约380 nm处,以水作参比,测定吸光度。其吸光度不应大于标准。标准是用移液管移取 3 mL 硒标准溶液,与试样同时同样处理。A.7 氯化物(以Cl计)的测定称取1.00 g±0.01 g试样,置于50 mL烧杯中,加10 mL水使试样溶解。然后全部转移至50 mL比色管中,加2 mL硝酸银溶液(17 g/L)和1 mL硝酸溶液(1+2),再加水至刻度,摇匀。置于暗处放置10 min,与标准比浊溶液比较,其浊度不应深于标准。标准比浊溶液是移取3.00 mL氯(Cl)标准溶液(0.l mg/mL),置于50 mL比色管中。与试样溶液同时同样处理。A.8 铁(Fe)的测定A.8.1 试剂和材料A.8.1.1 铁(Fe)标准溶液:0.01 mg/mL。A.8.1.2 其余同GB/T 3049—2006中第4章。A.8.2 仪器和设备分光光度计:配有光程为 4 cm 的比色皿。A.8.3 分析步骤A.8.3.1 工作曲线的绘制按GB/T 3049—2006中6.3的规定,使用4 cm比色皿,绘制铁含量为0.01 mg~0.1 mg工作曲线。A.8.3.2 测定称取约 10 g 试样,精确至 0.01 g,置于 150 mL 烧杯中,加 50 mL 水、5 mL 盐酸溶液,加热煮沸 4 min,取下冷却至室温。全部转移至 100 mL 容量瓶中,用水稀释至刻度,摇匀。用移液管移取 10 mL 试样溶液,置于 100 mL 容量瓶中,以下按 GB/T 3049—2006 中 6.4 从“必要时,加水至 60 mL??”开始进行操作。同时做空白试验,空白试样溶液除不加试样外,其他操作和加入的试剂与试样溶液相同。根据测得的吸光度,从工作曲线上查出相应的铁的质量(mg)。A.8.4 结果计算铁(Fe)含量的质量分数 w2,按式(A.2)计算:
式中: V1 ——滴定试样溶液消耗乙二胺四乙酸二钠(EDTA)标准滴定溶液的体积的数值,单位为毫升(mL); V0——滴定空白试样溶液所消耗的乙二胺四乙酸二钠标准滴定溶液体积的数值,单位为毫升(mL); c ——乙二胺四乙酸二钠(EDTA)标准滴定溶液的浓度的准确数值,单位为摩尔每升(mol/L); m——试样的质量的数值,单位为克(g); M——硫酸镁(MgSO4)的摩尔质量的数值,单位为克每摩尔(g/mol)(M=120.37); 25——移取试样溶液体积的数值,单位为毫升(mL); 250——容量瓶的容积的数值,单位为毫升(mL); 1000——换算因子。 实验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于 0.2%。 A.5 铅(Pb)的测定 A.5.1 试剂和材料 A.5.1.1 三氯甲烷。 A.5.1.2 盐酸。 A.5.1.3 硝酸。 A.5.1.4 氢氧化钠溶液:250 g/L。 A.5.1.5 吡咯烷二硫代甲酸铵(APDC)溶液:20 g/L。使用前过滤。 A.5.1.6 铅(Pb)标准溶液:0.005 mg/mL。 A.5.1.7 水:符合GB6682—2008中二级水的规定。 A.5.2 仪器和设备原子吸收分光光度计:配有铅空心阴极灯。 A.5.3 分析步骤 A.5.3.1 玻璃仪器的清洗 均以硝酸溶液(1+5)浸泡过夜,用自来水反复冲洗,最后用水冲洗干净。 A.5.3.2 试样溶液的制备称取约 5 g 试样,精确至 0.01 g,置于 150 mL 烧杯中,加 30 mL 水,加入 1 mL 盐酸。加热煮沸几分钟,冷却,用水稀释至 100 mL。用氢氧化钠溶液调整溶液 pH 为 1.0~1.5。将此溶液转移至 250 mL 分液漏斗中,用水稀释至约 200 mL。加 2 mL 吡咯烷二硫代氨基甲酸铵(APDC)溶液,混合。分别用 20 mL 三氯甲烷萃取两次,收集萃取物于 50 mL 烧杯中,蒸汽浴蒸发至干(此操作必须在通风橱中进行),于残渣中加入 3 mL 硝酸,继续蒸发至近干。加入 0.5 mL 硝酸和 10 mL 水,加热直至溶液体积约 3 mL~5 mL。转移至 10 mL 容量瓶,用水稀释至刻度,摇匀。A.5.3.3 空白试样溶液的制备取 30 mL 水置于 150 mL 烧杯中,加入 1 mL 盐酸。以下操作同 A.5.3.2 中“加热煮沸几分钟,冷却,用水稀释至 100 mL??转移至 10 mL 容量瓶,用水稀释至刻度,摇匀”。A.5.3.4 标准溶液的制备移取 2.00 mL 铅标准溶液置于 150 mL 烧杯中, 加入 1 mL 盐酸。以下操作同 A.5.3.2 中“加热煮沸几分钟,冷却,用水稀释至 100 mL??转移至 10 mL 容量瓶,用水稀释至刻度,摇匀”。A.5.3.5 分析步骤将试样溶液、标准溶液导入原子吸收分光光度计中,于波长 283.3 nm 处,用空气-乙炔火焰,以空白试样溶液调零,测量吸光度。试样溶液的吸收值不应高于标准溶液吸收值。A.6 硒(Se)的测定A.6.1 试剂和材料A.6.1.1 盐酸羟胺。A.6.1.2 环己烷。A.6.1.3 盐酸溶液:1+1。A.6.1.4 氨水溶液:1+1。A.6.1.5 2,3-二氨基萘溶液:称取0.1 g 2,3-二氨基萘和0.5 g盐酸羟胺,溶解在0.1 mol/L的盐酸溶液中,制成100 mL溶液。A.6.1.6 硒(Se)标准溶液:0.01 mg/mL。A.6.2 仪器和设备分光光度计,配有光程为1 cm的比色皿。A.6.3 分析步骤称取约1 g试样,精确至0.000 2 g,置于150 mL烧杯中,加25 mL水,5 mL盐酸溶液,搅拌,加热煮沸15 min,冷却。用氨水溶液调节pH为2±0.2(用精密pH试纸检查),加入0.2 g盐酸羟胺,搅拌至溶解,立即加入5 mL 2,3-二氨基萘溶液,混匀。盖上表面皿,在室温下静置100 min。然后全部转移至125 mL分液漏斗中,补加水至约60 mL。用移液管加10 mL环己烷,用力振荡2 min,静置分层后,弃去水层。用1 cm的比色管,在波长约380 nm处,以水作参比,测定吸光度。其吸光度不应大于标准。标准是用移液管移取 3 mL 硒标准溶液,与试样同时同样处理。A.7 氯化物(以Cl计)的测定称取1.00 g±0.01 g试样,置于50 mL烧杯中,加10 mL水使试样溶解。然后全部转移至50 mL比色管中,加2 mL硝酸银溶液(17 g/L)和1 mL硝酸溶液(1+2),再加水至刻度,摇匀。置于暗处放置10 min,与标准比浊溶液比较,其浊度不应深于标准。标准比浊溶液是移取3.00 mL氯(Cl)标准溶液(0.l mg/mL),置于50 mL比色管中。与试样溶液同时同样处理。A.8 铁(Fe)的测定A.8.1 试剂和材料A.8.1.1 铁(Fe)标准溶液:0.01 mg/mL。A.8.1.2 其余同GB/T 3049—2006中第4章。A.8.2 仪器和设备分光光度计:配有光程为 4 cm 的比色皿。A.8.3 分析步骤A.8.3.1 工作曲线的绘制按GB/T 3049—2006中6.3的规定,使用4 cm比色皿,绘制铁含量为0.01 mg~0.1 mg工作曲线。A.8.3.2 测定称取约 10 g 试样,精确至 0.01 g,置于 150 mL 烧杯中,加 50 mL 水、5 mL 盐酸溶液,加热煮沸 4 min,取下冷却至室温。全部转移至 100 mL 容量瓶中,用水稀释至刻度,摇匀。用移液管移取 10 mL 试样溶液,置于 100 mL 容量瓶中,以下按 GB/T 3049—2006 中 6.4 从“必要时,加水至 60 mL??”开始进行操作。同时做空白试验,空白试样溶液除不加试样外,其他操作和加入的试剂与试样溶液相同。根据测得的吸光度,从工作曲线上查出相应的铁的质量(mg)。A.8.4 结果计算铁(Fe)含量的质量分数 w2,按式(A.2)计算:![]()
式中:
m1——从工作曲线上查出的试样溶液中铁的质量的数值,单位为毫克(mg);
m0——从工作曲线上查出的空白试样溶液中铁的质量的数值,单位为毫克(mg);
m——试样质量的数值,单位为克(g);
10——移取试样溶液的体积的数值,单位为毫升(mL);
100——容量瓶的容积的数值,单位为毫升(mL);
1000——换算因子。
实验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于 2 mg/kg。
A.9 灼烧减量的测定A.9.1 仪器和设备A.9.1.1 电热恒温干燥箱:控制温度105 ℃±2 ℃。
A.9.1.2 高温炉:控制温度450 ℃±25 ℃。
A.9.2 分析步骤称取约1 g试样,精确至0.000 2 g,置于在450 ℃±25 ℃下质量恒定的瓷坩埚中,于105 ℃±2 ℃电热恒温干燥箱中烘2 h,再移入450 ℃±25 ℃的高温炉中灼烧至质量恒定。
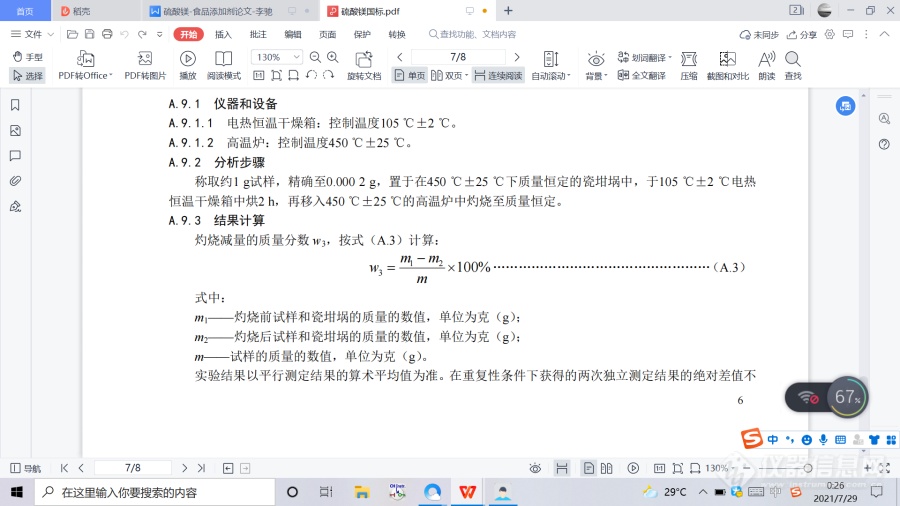
A.9.3 结果计算灼烧减量的质量分数 w3,按式(A.3)计算:
![]()
式中:
m1——灼烧前试样和瓷坩埚的质量的数值,单位为克(g);
m2——灼烧后试样和瓷坩埚的质量的数值,单位为克(g);
m——试样的质量的数值,单位为克(g)。
实验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于 0.05%。
参考文献:[1] 马建华,王宝仁,王秀艳.用纯橄岩制备硫酸镁的工艺研究[J].无机盐工业,2009,41(11):31-33.
[2]GB 29207-2012 食品安全国家标准 食品添加剂 硫酸镁
[3]牛韩根. 中温转化—冷却结晶法制备硫酸镁原理及工艺研究[D].中国科学院研究生院(青海盐湖研究所),2016.
[4]李晓波.用苦卤制取工业硫酸镁[J].海湖盐与化工,2002(06):26-27.
[5]邱星群. “增肥”黑木耳中硫酸镁的检测[A]. 中国职协2014年度优秀科研成果获奖论文集(下册)[C].:中国职工教育和职业培训协会秘书处,2014:8.