相信我们做
液质的实验室现在都在忙一个东西“塑化剂”的检测,本人也很荣幸最近在建立塑化剂的方法,具体是根据台湾FDA方法进行一些小改动,但是在建立这个方法的时候遇到了很多的问题,希望和大家分享一下,也希望有助于大家查找一些问题的根源。
首先,把我们的仪器配置说一下,Agilent 1290+ Agilent 6460,Agilent 1260+API 5500。
下面就是一些做这个方法的心得和遇到的问题及解决方法,
1。色谱条件的优化
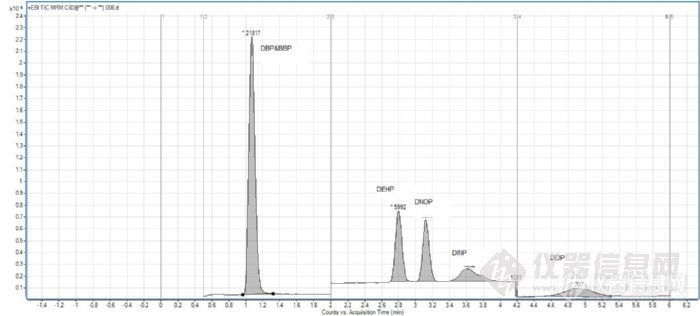
首先从台湾的方法,包括各个仪器公司推荐的方法看,好多物质的定量Transition都是149,因为这个子离子在Methanol包括整个实验室都有很多污染,所以开始的时候我们想避开Methanol,选择ACN作为Organic solvent,可是问题是当选择ACN的时候在优化梯度的时候,当进完一针标准品,后进一针“-1”位去check色谱柱是不是有carryover的时候,发现DBP和DEHP有很大的响应。后来由于这个原因放弃了ACN选择MeOH,并且把色谱条件改成较高的柱温例如50度,色谱柱平衡很长的时间10min,通过这样把残留在色谱柱上的DBP和DEHP清洗掉,用现在的方法我们同时会看到在大约9min的时候会冲出来很多DBP和 DEHP的残留。下面是6个物质的TIC图。
![]()
2。DBP标准曲线和空白
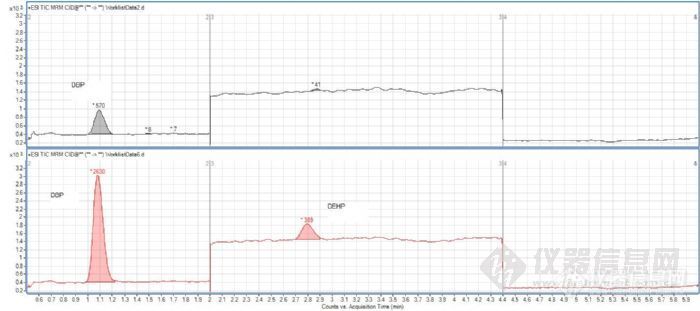
由于我们用的标准品是从Sigma订购的混标,所以当我同时做标曲的时候从0-100ppb,DBP和BBP在高浓度下有响应饱和的因素存在,所以不能同时兼顾高低浓度(由于Mass灵敏度高),但是这不是主要问题,关键是DBP不成线性,在一些浓度下的响应很异常。
由于此原因怀疑是来自实验室的污染太大,所以我们对实验室整个玻璃器皿进行污染残留查找,结果发现DBP和DEHP是主要的污染,并且如果你的玻璃进样瓶也会有很大的残留。可能的话大家一定要用MeOH清洗一下,或者卖经过Mass认证的小瓶。
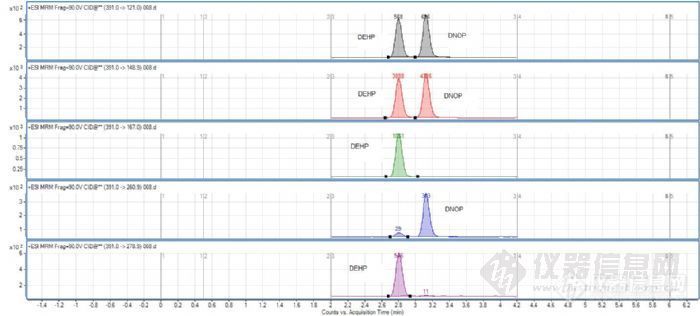
3。DEHP和DNOP Transition的选择
为什么把这两个物质提出来呢?因为这两个物质首先母离子的m/z一样,并且有一个极高响应的子离子149,并且在色谱柱上还不容易分离,如果色谱条件没有选择恰当,这两个物质还可能同时洗出,这就比较麻烦了,如果是这样的话可能会干扰你样品的定量,所以要么选择色谱柱尽量分离他们,要么放弃149这个Transition,综合来看最好的还是尽量分离的同时放弃149。
![]()