吕乐琪
抗坏血酸的性质及国标测定方法简介
目录
抗坏血酸的性质及国标测定方法简介1一、CNS_04.014抗坏血酸3二、抗坏血酸的应用.42.1在果蔬中的应用42.1.1果蔬保鲜42.1.2抗褐变52.2在茶叶和茶饮料中的应用52.2.1保护茶多酚稳定性52.2.2提高红茶的品质52.3在面制品中的应用62.3.1改善蛋白质性质62.3.2提高面团流变学特性62.4在肉制品中的应用62.4.1抑制脂肪氧化62.4.2降低亚硝酸盐含量62.5在葡萄酒中的应用——作为SO2补充剂7三、抗坏血酸的检测方法73.1滴定法(以2,6-二氯酚靛酚为指示剂)73.1.1原理73.1.2仪器与试剂(均为分析纯)83.1.3实验步骤83.1.4结果计算93.1.5特点93.2高效[url=https://insevent.instrument.com.cn/t/5p]液相色谱法测维生素C含量[/url]
93.2.1原理93.2.2仪器与试剂103.2.3实验步骤103.2.4结果计算113.2.5特点123.3荧光法测抗坏血酸含量123.3.1原理123.3.2仪器与试剂123.3.3实验步骤133.3.4结果计算133.3.5特点14一、CNS_04.014抗坏血酸1.1抗坏血酸(维生素C)的简介维生素C(英语:VitaminC/ascorbicacid,又称L-抗坏血酸,又译维他命C)是高等灵长类动物与其他少数生物的必需营养素。维生素C是一种存在于食物中的维他命,可作为营养补充品。维生素C在大多数生物体内可借由新陈代谢制造出来,但是有许多例外,比如人类,缺乏维生素C会造成坏血病。
抗坏血酸可作
营养补充剂以预防或治疗坏血病,药效基团是
抗坏血酸离子。
在生物体内,维生素C是一种抗氧化剂,因为它能够保护身体免于氧化剂的威胁,维生素C同时也是一种辅酶。
含有维他命C的食物包含柑橘类水果、番茄以及马铃薯。当它作为
食品添加剂,维生素C也是一种抗氧化剂和防腐剂的
酸度调节剂。多个E编码收录维生素C,不同的数字取决于它的化学结构,像是E300是抗坏血酸,E301为
抗坏血酸钠盐,E302为
抗坏血酸钙盐,E303为抗坏血酸钾盐,E304为酯类抗坏血酸棕榈和抗坏血酸硬脂酸,E315为
异抗坏血酸除虫菊酯。
维他命C最早发现于1912年,在1928年首次被分离出来,在1933年首次被制造出来,于
世界卫生组织基本药物标准清单上名列有案,是建立照护系统时相当重要的必备基础药物之一。维他命C已经是通用名药物,也是成药。在发展中国家的批发价约在每月0.19到0.54美元之间,有些国家将抗坏血酸加入食物,像是营养麦片。
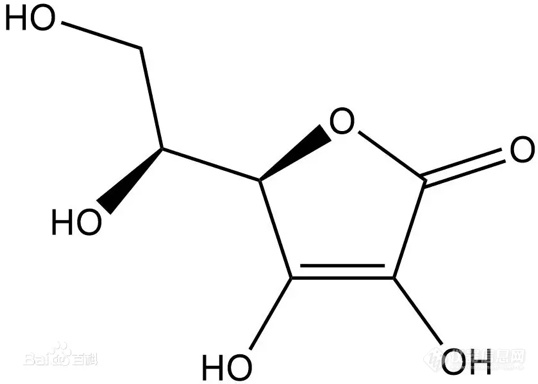
![]() 1.2抗坏血酸的理化性质
1.2抗坏血酸的理化性质抗坏血酸是一种
多羟基化合物,化学式为C6H8O6。结构类似
葡萄糖,其分子中第2及第3位上两个相邻的烯醇式羟基极易解离而释出H+,故具有酸的性质,又称L-抗坏血酸。维生素C具有很强的
还原性,很容易被氧化成脱氢维生素C,但其反应是可逆的,并且抗坏血酸和脱氢抗坏血酸具有同样的生理功能,但脱氢抗坏血酸若继续
氧化,生成二酮古乐糖酸,则反应不可逆而完全失去生理效能。
维生素C为白色结晶或结晶性粉末,无臭,味酸,久置色渐变微黄。在水中易溶,呈酸性,在乙醇中略溶,在三氯甲烷或乙醚中不溶。[3]维生素C分子结构中具有烯二醇结构,C2-OH由于受共轭效应影响,酸性极弱(pK2=11.57),C3-OH酸性则较强(pK1=4.17),故维生素一般表现为一元酸,可与碳酸氢钠作用呈钠盐。[3]维生素C分子结构中含有2个手性碳原子,因而具有旋光性。分子结构中的烯二醇基具有极强的还原性,易被氧化成二酮基而成为去氢抗坏血酸,去氢抗坏血酸在碱性溶液或强酸性溶液中可进一步水解生成二酮古洛糖酸而失去活性。维生素C和碳酸钠作用可生成单钠盐,不致发生水解,因双键使内酯环变得稳定,但在强碱溶液中,内酯环可水解,生成酮酸盐。维生素C的结构与糖相似,因而具有糖类性质的反应。维生素C分子中具有共轭双键,其稀盐酸溶液在243nm处有最大吸收,若在中性或碱性条件下,则红移至265nm。1.3抗坏血酸的生理功能抗坏血酸促进骨胶原的生物合成,利于组织创伤口的更快愈合;可以促进氨基酸中酪氨酸和色氨酸的代谢,延长肌体寿命,可以改善铁、钙和叶酸的利用;改善脂肪和类脂特别是胆固醇的代谢,预防心血管疾病。促进牙齿和骨骼的生长,防止牙床出血,防止关节痛、腰腿痛。增强肌体对外界环境的抗应激能力和免疫力。水溶性强抗氧化剂,主要作用在体内水溶液中。坚固结缔组织;促进胶原蛋白的合成,防止牙龈出血。
2、 抗坏血酸的应用2.1在果蔬中的应用2.1.1果蔬保鲜AA是植物体内重要的抗氧化物质,有研究表明,若在采后贮藏过程提高了果蔬的AA含量,就能提高果蔬采后保鲜效果。用5%AA溶液处理对CO2脱涩柿果进行保鲜,发现外源AA处理更好地延缓柿果实硬度的降低和总色差的升高,同时,外源AA阻滞了整个贮藏期果实内源AA的减少,果实自身抗氧化体系功能受到保护,此外,AA处理还在一定程度上提高了果实还原糖的含量。
单独使用AA进行果蔬保鲜,保鲜效果有限,若想提高保鲜效果,一般用AA结合不同抗氧化剂、抑菌剂或者结合不同保鲜手段共同提高果蔬保鲜的效果。
2.1.2抗褐变水果和蔬菜在运输、包装或加工过程中受损后极易发生变色,这种现象被称为酶促褐变。酶促褐变反应的基本步骤是将酚类化合物在酚酶催化下氧化成邻醌类化合物,随后醌类物质经过一系列氧化缩合聚合形成褐色产物,从而导致褐变发生。
AA是常见的抗褐变剂,它可以通过2种不同的机制防止褐变:在没有多酚氧化酶(Polyphenoloxidase,PPO)底物的情况下,它使PPO不可逆地失活,可能是通过与其活性位点的结合;在存在PPO底物的情况下,AA会还原PPO氧化的反应产物,即与氧化形成的醌发生偶合氧化,醌被还原,导致苯酚的再生,从而抑制褐变。
2.2在茶叶和茶饮料中的应用2.2.1保护茶多酚稳定性在茶叶和茶饮料的加工过程中,由于儿茶素(EGCG)结构中有活性酚羟基,在不利的环境条件下会发生水解、氧化、异构化等反应。之前研究发现AA对儿茶素的异构化有一定的抑制作用,且具有明显的剂量效应,添加的AA浓度越高,抑制儿茶素异构化效果越好。而最新研究发现AA浓度对EGCG的稳定性有双重作用,其机制可能与AA的可逆反应以及氧化中间产物有关。低浓度时,AA对EGCG保护作用呈剂量依赖性,随着AA浓度的增加保护作用逐渐增强;高浓度时,AA对EGCG起促进降解作用,临界浓度约为10mmol/L。
具有保护作用的原因是AA具有比EGCG更强的还原能力,因此可以首先氧化成脱氢抗坏血酸(Dehydroascorbicacid,DHAA),从而抑制EGCG氧化成EGCG-醌或其他活性中间体并进一步聚合途径。促进降解的主要原因是AA的氧化产物DHAA积累到一定量后,可以与EGCG反应生成一些新产物。换句话说,DHAA可以促进EGCG的氧化。当DHAA达到足够高的浓度(约为10mmol/L)时,反应很容易进行。
2.2.2提高红茶的品质AA有利于提高茶黄素、茶红素含量,减少聚合反应的发生。茶黄素和茶红素的含量直接关系到红茶的品质,而聚合产物对红茶品质有不利影响。在氧化过程中添加AA可提高茶叶的整体品质参数,茶在酸性条件下是稳定的,添加AA可以减少茶中儿茶素的降解。在氧化过程中,加入AA与儿茶素反应生成稳定的次生多酚。添加AA可使茶黄素的生成量从1.23%提高到1.77%。
此外,由于氧气量减少,多酚进一步聚合成其他物质也会受阻。在最佳水平添加AA不会改变茶汤的内在品质和相关属性。茶汤的稳定性和总色泽由3.82%提高到4.72%。由于提高天然AA的含量是困难的,因此在加工过程中添加抗坏血酸是值得探索的,AA也是生物合成茶黄素、茶红素等多种次生多酚的工具。
2.3在面制品中的应用2.3.1改善蛋白质性质AA因在水溶液中不稳定,存在氧化-还原性的抗坏血酸系统(AA、AA自由基、DHAA)。研究表明AA的第一个稳定的氧化产物DHA和其他进一步氧化产物(苏糖、草酸等),其活性羰基基团都可以与氨基酸残基交联,也有学者认为DHA参与—SH基与二硫键之间的交换反应,通过此交换反应增加分子的展开,并通过分子间二硫键的形成增强蛋白质-蛋白质的相互作用,以上作用都有可能影响蛋白质性质。
目前,蛋白膜是一种可降解的“绿色包装材料”,在众多天然高分子膜材料中展现出独特的优势。但是,蛋白膜由于自身的机械阻隔性能不佳、易氧化等缺点使其在食品包装领域中受到极大的局限。一般会向膜中添加AA以改善蛋白膜的性能。
此外,AA还会改变酶和蛋白质的构象和微环境。AA对淀粉酶具有激活作用,能够与淀粉酶相互作用改变淀粉酶的微环境和空间结构。AA与牛血清白蛋白的结合是由有利的焓和不利的熵驱动的,主要的驱动力是氢键和范德华力,AA可引起牛血清白蛋白的构象和微环境变化。
2.3.2提高面团流变学特性AA在面包面团的流变学特性中起着重要作用。在面包加工中,氧化剂能显著增强面筋的筋力。AA作为一种中速氧化剂,主要在面团搅拌后期和醒发期间起氧化作用。张磊[21]研究表明,添加AA可以改善面团吸水率、形成时间、稳定时间强度,同时提高了面团拉伸面积和拉伸阻力。
2.4在肉制品中的应用2.4.1抑制脂肪氧化AA既能抑制脂类氧化,又能提高乳液的抗氧化性。油脂氧化是油脂类食品的一个严重问题,它对食品的保质期和营养成分都有负面影响。由于AA良好的还原性可以清除食物中的氧气,保护油脂不被氧化。乳状液体系中油脂部分的氧化是导致乳状液质量下降的原因之一。为了控制和提高乳液的稳定性,可以添AA通过降低乳液的溶氧量,抑制油脂氧化中自由基的产生,降低过渡金属离子的促氧化能力,实现抗氧化效果。
2.4.2降低亚硝酸盐含量亚硝酸盐与肉制品中胺类反应生成亚硝胺,食用后存在潜在的致癌作用。AA作为抗氧化剂,在酸性条件下能将亚硝酸盐还原为NO,消耗NO2—,从而降低了亚硝酸盐浓度[25]。
2.5在葡萄酒中的应用——作为SO2补充剂
SO2通常作为保护剂添加到葡萄酒中,它既是一种杀菌剂,能够有效杀死葡萄中的杂菌,又是一种抗氧化剂,在保护酒液的天然水果特性的同时,防止酒液老化。美国于1956年批准在葡萄酒和果汁生产中使用AA。与SO2相比,由于AA的抑制微生物腐败变质的能力有限,认识到AA仅应与SO2起补充作用而不能起替代作用。AA作为抗氧化剂在白酒中的有益作用是在酚类化合物氧化之前清除分子氧[27]。相比之下,SO2清除分子氧的效率不高此外,如果酚类化合物确实发生了氧化,AA还能将酚类氧化产物还原回原来的酚醛状态。然而,大多数关于葡萄汁或葡萄酒的研究并未区分AA的除氧能力和其还原醌化合物的能力。仅在(+)-儿茶素水溶液中建立AA还原这种醌的直接证据。总之,将AA与SO2结合使用,可以使分子氧更有效地清除,因此与单独的SO2相比,对葡萄酒的保护作用更大。
3、 抗坏血酸的检测方法3.1滴定法(以2,6-二氯酚靛酚为指示剂)3.1.1原理氧化型2,6一二氯酚靛酚在酸性溶液中呈粉红色,在中性或碱性溶液中呈蓝色,当用此染料滴定含有抗坏血酸的酸性溶液时,在抗坏血酸未全部氧化前,则滴下染料立即被还原成无色,一旦溶液中的抗坏血酸全部被氧化时,则滴下的染料立即使溶液显示粉红色,此时为滴定终点,即表示溶液中的抗坏血酸刚刚被氧化完全,从滴定时2,6-二氯酚靛酚标准液的消耗量,可以计算出被检物质中抗坏血酸的含量。
![]()
3.1.2仪器与试剂(均为分析纯)1. 偏磷酸(HPO
3)
n:含量(以HPO
3计)≥38%。
2. 草酸(C2H2O4)。
3. 碳酸氢钠(NaHCO
3)。
4. 2,6-二氯靛酚(2,6-二氯靛酚钠盐,C
12H
6Cl
2NNaO
2)。
5. 白陶土(或高岭土):对抗坏血酸无吸附性。
3.1.3实验步骤1.对2,6-二氯酚靛酚标准溶液的标定
称取2,6-二氯靛酚钠约0.1g加水溶解后用水定容至1000mL容量瓶中,棕色试剂瓶中冷藏保存。在锥形瓶中加入10mL刚配置好的标准维生素C溶液,用蓝色的2,6-二氯酚靛酚标准溶液滴定,边滴定边摇晃,使染料与标准维生素C溶液完全反应。待烧杯内溶液颜色变为淡红色且在15s内既不褪色也不发生变化,此时的状态即为滴定终点,停止滴定。记录2,6-二氯酚靛酚溶液的消耗量,根据消耗的体积按照公式换算出滴定度T(每毫升2,6-二氯酚靛酚标准溶
液相当多少毫克维生素C)
C为维生素C的浓度(mg·mL
-1);V
1为移取标准维生素C的体积(mL);V
2为消耗2,6-二氯酚靛酚标准溶液的体积(mL)
2样品前处理
称取10g样品,放入组织破碎机,加入等量2%草酸溶液后匀速运行3min,将溶液浆倒入烧杯,用少量2%草酸冲洗3次组织破碎机,将冲洗液倒入烧杯。快速将烧杯内溶液过滤至100mL容量瓶,并用1%草酸稀释至刻度线进行定容。1.3.4样品滴定准确吸取样品溶液10mL于烧杯中,用2,6-二氯酚靛酚溶液进行滴定,仔细观察烧杯内液体颜色变化。当烧杯内液体变为淡红色时,并且在15s内淡红色不褪色,则停止滴定。记录滴定前、滴定后的染液读数,重复操作3次取平均值并记录。
3.1.4结果计算式中:
X一试样中L(+)-抗坏血酸含量,单位为毫克每百克(mg/100g);
V一滴定试样所消耗2,6-二氯靛酚溶液的体积,单位为毫升(mL);
Vo-滴定空白所消耗2,6-二氯靛酚溶液的体积,单位为毫升(mL);
T--2,6-二氯靛酚溶液的滴定度,即每毫升2,6-二氯靛酚溶
液相当于抗坏血酸的毫克数
(mg/mL);
A一稀释倍数;
m一试样质量,单位为克(g)。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
3.1.5特点2,6一二氯酚靛酚滴定抗坏血酸的方法操作简单,快速,价格低廉,而且无需特殊仪器,是比较传统的定量分析方法,适用于水果、蔬菜及其制品中L(+)-抗坏血酸的测定。
但由于滴定过程中需要用肉眼来观测溶液颜色的变化以确定滴定终点,存在较大的人为误差,且无法应用于有色的样品的维生素C含量的测定。
3.2高效液相色谱法测维生素C含量3.2.1原理![]()
高效
液相色谱法能够利用被检测溶液中溶质,在固定相于流动相之间进行连续交换的特性来实现溶质的分离。通常情况下,不同的溶质在固定相与流动相之间的分配系数和亲和力都有着一定的差异。因此,被检测溶液中的不同溶质在经过色谱系统时的速度也有所差异,高效
液相色谱法正是利用这一特点来实现对被检测溶液中不同溶质的分离与检测。
高效
液相色谱系统主要由流动相、泵、进样器、固定相、检测器、数据系统与废液等几部分组成。储液瓶中的流动相在泵的高压作用下被吸入色谱系统,被检测溶液由进样器注入,并随着流动相通过色谱柱,在色谱柱中进行溶质分离,检测器能够对有效地对所分离的溶质进行检测,并由数据处理设备对检测信号进行采集与处理,废液流入废液瓶。
用偏磷酸提取水果或蔬菜样品中L-抗坏血酸、D-异抗坏血酸和脱氢抗坏血酸,提取液中的L-抗坏血酸、D-异抗坏血酸可直接进行检测,脱氢抗坏血酸在磷酸钠溶液中(pH7.0~7.2)用L-半胱氨酸还原成L-抗坏血酸,之后测定以L-抗坏血酸表达总维生素C含量,脱氢抗坏血酸含量由总维生素C含量减去L-抗坏血酸含量获得。
3.2.2仪器与试剂1. 偏磷酸(HPO
3):含量(以HPO
3计)≥38%。
2. 磷酸三钠(NagPO
4·12H
2O)。
3. 磷酸二氢钾(KH
2PO4)。
4. 磷酸(H
3PO
4):85%。
5. L-半胱氨酸(C
3H
7NO
2S):优级纯。
6. 十六烷基三甲基溴化铵(C
19H
42BrN):色谱纯。
7. 甲醇(CH
3OH):色谱纯。5.1
液相色谱仪:配有二极管阵列检测器或紫外检测器。
8. pH计:精度为0.01。
9. 天平:感量为0.1g.1mg、0.01mg。
10. 超声波清洗器。
11. 离心机:转速≥4000r/min。
12. 均质机。
13. 滤膜:0.45μm水相膜。
14. 振荡器。
3.2.3实验步骤1.标准溶液配制
称取维生素C标准品0.1000g,用20g·L
-1偏磷酸溶液配制成质量浓度为1.0×104mg·L
-1的标准储备溶液,于-4℃避光保存。准确吸取质量浓度为1.0×104mg·L-1的标准储备溶液1mL至10mL容量瓶中,用20g·L
-1偏磷酸溶液定容至刻度,得1.0×103mg·L-1维生素C中间液。使用时分别吸取维生素C中间液及苯甲酸标准溶液各1mL至10mL容量瓶中,用20g·L
-1偏磷酸溶液定容至刻度,得100mg·L
-1混合标准溶液,现用现配。
2.样品前处理
称取样品5g(精确至0.001g)于50mL离心管中,用20g·L
-1偏磷酸溶液定容至25mL,涡旋混匀后超声30min,于5000r·min
-1离心5min,取上清液过0.22μm滤膜上机进样。
3.仪器参考条件.
(1) 色谱柱:C18柱,柱长250mm,内径4.6mm,粒径5μm,或同等性能的色谱柱。
(2) 检测器:二极管阵列检测器或紫外检测器。
(3) 流动相:A:6.8g磷酸二氢钾和0.91g十六烷基三甲基溴化铵,用水溶解并定容至1L(用磷酸调
(4) pH至2.5~2.8);B:100%甲醇。按A:B=98:2混合,过0.45pm滤膜,超声脱气。
(5) 流速:0.7mL/min..
(6) 检测波长:245nm。
(7) 柱温:25°C。
(8) 进样量:20μL。
4.标准曲线的绘制
分别对抗坏血酸混合标准系列工作溶液进行测定,以L(+)-抗坏血酸[或D(-)-抗坏血酸]标准溶液的质量浓度(μg/mL)为横坐标,L(+)-抗坏血酸[或D(一)-抗坏血酸]的峰高或峰面积为纵坐标,绘制标准曲线或计算回归方程。
![]()
5.试样溶液的测定
对试样溶液进行测定,根据标准曲线得到测定液中L(+)-抗坏血酸[或D(-)-抗坏血酸]的浓度(μg/mL)。
6.空白试验
空白试验系指除不加试样外,采用完全相同的分析步骤、试剂和用量,进行平行操作。
3.2.4结果计算试样中L(+)-抗坏血酸[或D(-)-抗坏血酸]的含量和L(+)-抗坏血酸总量以毫克每百克表示,
X-试样中L(+)-抗坏血酸[或D(一)-抗坏血酸、L(+)-抗坏血酸总量]的含量,单位为毫克每百克(mg/100g);
C1-样液中L(+)-抗坏血酸[或D(-)-抗坏血酸]的质量浓度,单位为微克每毫升(μg/mL);.
Co-样品空白液中L(+)-抗坏血酸[或D(-)-抗坏血酸]的质量浓度,单位为微克每毫升(μg/mL);
V-试样的最后定容体积,单位为毫升(mL);
m-实际检测试样质量,单位克(g);
1000-换算系数(由μg/mL换算成mg/mL的换算因子;
F-稀释倍数(若使用6.3还原步骤时,即为2.5);
K-若使用6.3中甲醇沉淀步骤时,即为1.25;
100-换算系数(由mg/g换算成mg/100g的换算因子。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
3.2.5特点(1) 高压。在高效
液相色谱系统当中,泵的输出高压能够为载液的流动提供动力,不仅能够有效提升载液的流动速度,而且能够有效提升分离速度。
(2) 高速。由于高效
液相色谱系统采用了高压输送的方式,使得溶质检测的速率得到了大幅度的提升。通常情况下,样品的检测可以在数十分钟之内即可完成,有些样品甚至只需要短短的几分钟即可完成检测。高效
液相色谱法的高速特点是其他分离技术所达不到的,这是高效
液相色谱法最为突出的优点之一。
(3) 高效。高效
液相色谱法的高效特点是指其具有较高的分离效能。高效
液相色谱法利用不同溶质在不内向与流动相之间分配不同来实现溶质的分离,且同时可以对多种溶质进行分离。与此同时,其在分离效果上也有着十分优异的表现,甚至能超过工业精馏塔的分离效能。
(4) 高灵敏度。高效
液相色谱系统的检测器精度可以达到0.01ng。
(5) 应用范围广。高效液压色谱法可以满足绝大多数有机化合物的分离与分析。除此之外,高效
液相色谱法还具有分析选择灵活的特点。对于不同溶质的检测,通过选择合适的流动相,可以使得溶质的分离速度与效果更加良好。
(6) 适用于乳粉、谷物、蔬菜、水果及其制品、肉制品、维生素类补充剂、果冻、胶基糖果、八宝粥、葡萄酒中的L(+)-抗坏血酸、D(-)-抗坏血酸和L(+)-抗坏血酸总量的测定
3.3荧光法测抗坏血酸含量3.3.1原理维生素C自身没有荧光,维生素C先被活性炭(Norit)氧化为脱氢抗坏血酸(DHAA),DHAA再与荧光底物邻苯二胺(OPDA)结合生成荧光产物,再与邻苯二胺(OPDA)反应产生具有荧光的喹喔啉,其荧光强度与维生素C的浓度在一定范围内呈线性关系,以此测定试样中L(+)-抗坏血酸总量。
3.3.2仪器与试剂1. 偏磷酸(HPO
3)。:含量(以HPO3计)≥38%。
2. 冰乙酸(CH
3COOH):浓度约为30%。
3. 硫酸(H
2SO
4):浓度约为98%。
4. 乙酸钠(CH
3COONa)。
5. 硼酸(H
3BO
3)。
6. 邻苯二胺(C:HgN
2)。
7. 百里酚蓝(C
27H
30O
5S)。
8. 活性炭粉。
9. 荧光分光光度计:具有激发波长338nm及发射波长420nm。配有1cm比色皿。
3.3.3实验步骤1.样品的制备
称取约100g(精确至0.1g)试样,加100g偏磷酸-乙酸溶液,倒入捣碎机内打成匀浆,用百里酚蓝指示剂测试匀浆的酸碱度。如呈红色,即称取适量匀浆用偏磷酸-乙酸溶液稀释;若呈黄色或蓝色,则称取适量匀浆用偏磷酸-乙酸硫酸溶液稀释,使其pH为1.2。
匀浆的取用量根据试样中抗坏血酸的含量而定。当试样液中抗坏血酸含量在40pg/mL~100μg/mL之间,一般称取20g(精确至0.01g)匀浆,用相应溶液稀释至100mL,过滤,滤液备用。
2. 样品的测定
2.1氧化处理
分别准确吸取50mL试样滤液及抗坏血酸标准工作液于200mL具塞锥形瓶中,加入2g活性炭,用力振摇1min,过滤,弃去最初数毫升滤液,分别收集其余全部滤液,即为试样氧化液和标准氧化液,待测定。
分别准确吸取10mL试样氧化液于两个100mL容量瓶中,作为“试样液”和“试样空白液”。
分别准确吸取10mL标准氧化液于两个100mL容量瓶中,作为“标准液”和“标准空白液”。
于“试样空白液”和“标准空白液”中各加5mL硼酸-乙酸钠溶液,混合摇动15min,用水稀释至100mL,在4C冰箱中放置2h~3h,取出待测。
于“试样液”和“标准液”中各加5mL的500g/L乙酸钠溶液,用水稀释至100mL,待测。
2.2标准曲线的制备
准确吸取上述“标准液”[L(+)-抗坏血酸含量10μg/mL]0.5mL,1.0mL,1.5mL,2.0mL,分别置于10mL具塞刻度试管中,用水补充至2.0mL。另准确吸取“标准空白液”2mL于10mL带盖刻度试管中。在暗室迅速向各管中加入5mL邻苯二胺溶液,振摇混合,在室温下反应35min,于激发波长338nm、发射波长420nm处测定荧光强度。以“标准液”系列荧光强度分别减去“标准空白液”荧光强度的差值为纵坐标,对应的L(+)-抗坏血酸含量为横坐标,绘制标准曲线或计算直线回归方程。
2.3试样测定
分别准确吸取2mL“试样液”和“试样空白液”于10mL具塞刻度试管中,在暗室迅速向各管中加入5mL邻苯二胺溶液,振摇混合,在室温下反应35min,于激发波长338nm、发射波长420nm处测定荧光强度。以“试样液”荧光强度减去“试样空白液”的荧光强度的差值于标准曲线上查得或回归方程计算测定试样溶液中L(+)-抗坏血酸总量。
3.3.4结果计算试样中L(+)-抗坏血酸总量,结果以毫克每百克表示:
X一试样中L(+)-抗坏血酸的总量,单位为毫克每百克(mg/100g);
c一由标准曲线查得或回归方程计算的进样液中L(+)抗坏血酸的质量浓度,单位为微克每毫升(μg/mL);
V一荧光反应所用试样体积,单位为毫升(mL);
m一实际检测试样质量,单位克(g);
F一试样溶液的稀释倍数;
100一换算系数;
1000一换算系数。
计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
3.3.5特点荧光分析是一种先进的分析方法,它比电子探针法、质谱法、光谱法、极谱法等都应用的较广泛和普及,这同荧光分析具有很多优点分不开的。
(1) 荧光分析所用的设备较简单,如目测荧光仪和荧光光度计构造非常简单完全可以自己制造。比起质谱仪、极谱仪和电子探针仪来它在造价上要便宜很多倍
(2) 荧光分析的最大特点是:分析灵敏度高、选择性强和使用简便。同时具备这三大特点的仪器并不多。在紫外线照射下能直接发射荧光的化学元素并不很多,所以对一些元素进行荧光分析时大部分采用间接测定法,这就是用有机试剂与被测定的元素组成络合物。这些络合物在紫外线照射下能发射出不同波长的荧光素,然后由荧光强度测定出该元素的含量。由于有机荧光试剂的品种繁多,用荧光分析可测定的元素有六十多种。
(3) 适用于乳粉、蔬菜、水果及其制品中L(+)-抗坏血酸总量的测定
4、 参考文献1. 翟中和,王喜忠,丁明孝.细胞生物学第四版.北京:高等教育出版社,2011:374
2. 王放.食品营养保健原理与技术:中国轻工业出版社,1996
3. 邹纯才.“十三五”规划教材药物分析第2版:江苏科学技术出版社,2018.02:173-174
4. 胡秋红,许丽遐主编.食品营养与卫生:北京理工大学出版社,2011.02:54-55
5. 李彩云,李洁,严守雷,王清章.抗坏血酸在食品中应用的研究进展[J].食品科技,2021,46(04):228-232.
6. 王传芬,韩玉,王英博,王梦洁,王小君,马文皎.果蔬中维生素C含量的测定及比较[J].农业与技术,2020,40(18):44-46.
7. 李书静,李可,姚新建,等.2,6-二氯靛酚钠测定果汁饮料中维生素C[J].光谱实验室,2011,28(05):2391-2394.
8. 梁云贞,董佩佩,黄秋婵.测定果蔬中维生素C含量的实验教学改革———2,6-二氯酚靛酚法[J].教育教学论坛,2019(02):279-280.
9. 王春华.高效
液相色谱技术在食品质量检测中的应用[J].现代面粉工业,2020,34(01):22-24.
10. 王军锋,李思佳,王晓兰.荧光法测石榴中维生素C[J].山东化工,2018,47(10):44-46.
11.
抗坏血酸结合自发气调包装对灵武长枣贮藏品质和抗氧化性的影响[J]. 刘慧,张静林,刘杰超,张光弟,方海田,张强,焦中高. 食品科学. 2021(01)
12.
4-HR与抗坏血酸对中华管鞭虾多酚氧化酶的抑制动力学模拟分析[J]. 周宇芳,胡建坤,郝云彬,相兴伟,杨会成,郑斌,肖金星. 食品科学. 2019(04)
13.
儿茶素异构化的促进和抑制因素研究[J]. 张丹,许兰,唐李俊,李博,屠幼英. 天然产物研究与开发. 2016(12)
14.
抗坏血酸对蛋白基美拉德反应产物的性质影响[J]. 高维,刘刚. 食品科技. 2016(05)
15.
L-抗坏血酸对面团特性的影响[J]. 张磊. 现代面粉工业. 2015(01)
16.
抗坏血酸、谷胱甘肽及半胱氨酸对α-淀粉酶及其光谱性质的影响[J]. 高义霞,王济沧,张继. 广东农业科学. 2012(21)
17.
乙醇、氯化钙和抗坏血酸对大豆分离蛋白凝胶性质的影响[J]. 王婵秋,迟玉杰. 中国粮油学报. 2010(07)
18.
冰温技术结合保鲜剂对南美白对虾品质的影响[J]. 凌萍华,谢晶. 食品科学. 2010(14)
19.
大豆蛋白交联玉米淀粉/Nano-TiO2包装膜的制备及圣女果保鲜应用[D]. 阴彤彤.东北农业大学 2019
20.
抗坏血酸对柿果实采后软化的调控作用及其机制研究[D]. 范灵姣.广西大学 2016
21.
Dual effects of ascorbic acid on the stability of EGCG by the oxidation product dehydroascorbic acid promoting the oxidation and inhibiting the hydrolysis pathway[J] . Lin Chen,Weiwei Wang,Jianyong Zhang, Hongchun Cui, Dejiang Ni, Heyuan Jiang. Food Chemistry . 2021
22.
Analysis of interactions between streptomycin sulphate and aqueous food acids (L-ascorbic acid and citric acid): Physico-chemical and spectroscopic insights[J] . Taniya Sharma,Ashwani Kumar,Shahid Shafi Shah,Rajinder K. Bamezai. The Journal of Chemical Thermodynamics . 2020 (prep)
23. Enhancing the quality of naturally oxidized tea with ascorbic acid[J] . Palanivel Murugesan, Gopal Venkateswaran, Gopalan Sathish, Veilumuthu Shanmugaselvan. International Journal of Advanced Engineering Research and Science . 2020 (4)
24.
Effect of ascorbic acid postharvest treatment on enzymatic browning, phenolics and antioxidant capacity of stored mung bean sprouts[J] . Ma?gorzata Sikora,Micha? ?wieca. Food Chemistry . 2018
25. Landi Marco,Degl’Innocenti Elena,Guglielminetti Lorenzo,Guidi Lucia. Journal of the science of food and agriculture . 2013 (8)
26.
Effect of plant polyphenols and ascorbic acid on lipid oxidation, residual nitrite and N‐nitrosamines formation in dry‐cured sausage[J] . Ling Li,Junhua Shao,Xudong Zhu,Guanghong Zhou,Xinglian Xu. Int J Food Sci Technol . 2013 (6)
27. GB5009. 86—2016 食品安全国家标准——食品中抗坏血酸的测定

 1.2抗坏血酸的理化性质
1.2抗坏血酸的理化性质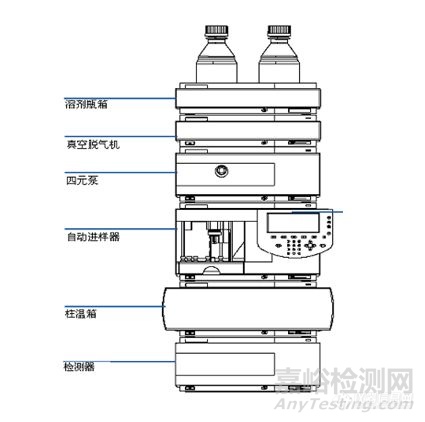 高效液相色谱法能够利用被检测溶液中溶质,在固定相于流动相之间进行连续交换的特性来实现溶质的分离。通常情况下,不同的溶质在固定相与流动相之间的分配系数和亲和力都有着一定的差异。因此,被检测溶液中的不同溶质在经过色谱系统时的速度也有所差异,高效液相色谱法正是利用这一特点来实现对被检测溶液中不同溶质的分离与检测。
高效液相色谱法能够利用被检测溶液中溶质,在固定相于流动相之间进行连续交换的特性来实现溶质的分离。通常情况下,不同的溶质在固定相与流动相之间的分配系数和亲和力都有着一定的差异。因此,被检测溶液中的不同溶质在经过色谱系统时的速度也有所差异,高效液相色谱法正是利用这一特点来实现对被检测溶液中不同溶质的分离与检测。