“ 在色谱分析方法开发工作中,我们经常遇到在C18上没有保留的样品,比如糖类、氨基酸、盐类等极性或离子化的分析物。通常我们会通过一些方法来增强保留,比如流动相添加离子对试剂或对分析物进行衍生化,但离子对试剂会有对色谱材料改性,对质谱等检测器造成污染等问题,而衍生化操作繁琐,也有定量准确性问题和重现性问题,而互补反相模式的亲水作用色谱-Hilic模式可能是更好的选择。”01
—
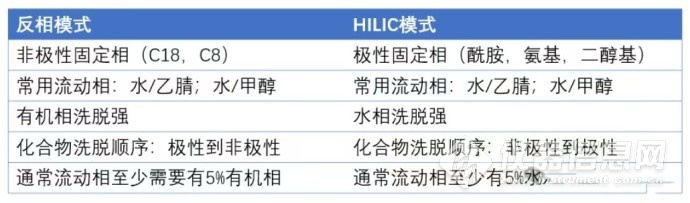
Hilic模式与反相模式的对比其实当遇到C18不保留的极性分析物时,我们可以尝试另一种分离模式——Hilic模式。也叫亲水作用色谱模式,它互补于反相模式,水相洗脱能力更强,对极性(亲水性)越大的分析物吸附力越强。详见下表。
![]()
02
—
HILIC保留机制
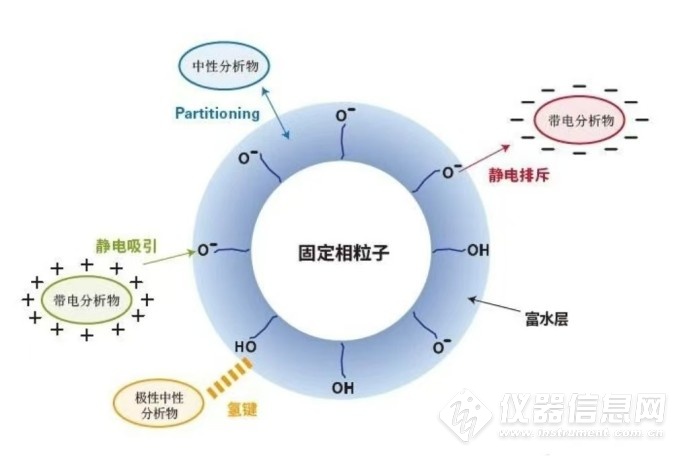
上表中提到Hilic的分离模式水的比例不少于5%,这是由其保留机制决定的,普遍认为Hilic模式流动相中的水会被吸附到极性固定相的表面形成水膜,然后分析物在水膜和流动相之间进行液液分配作用,加上极性官能团和固定相之间的氢键作用力,离子官能团之间的静电作用力等,实现被分析物的保留。水膜的作用非常重要,所以Hilic流动相中至少含有5%的水。
![]()
03
—
案例分析
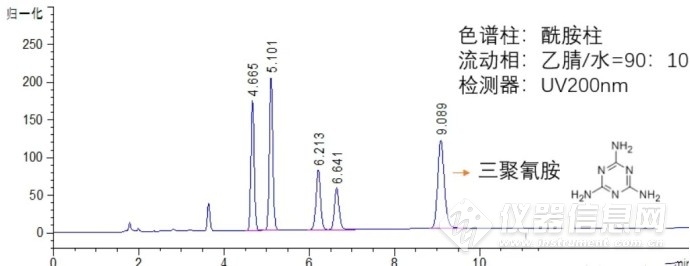
我们看一下具体实例,氰胺类衍生物极性是比较大的,比如三聚氰胺在C18柱上没有保留,而在酰胺柱上保留和分离很好,
(下图9min为三聚氰胺)。
![]()
上图中的三聚氰胺采用的是紫外检测器,选用200nm,末端吸收。而像糖类、氨基酸等大极性化合物往往是没有紫外吸收的,那就只能采用CAD、ELSD、RID或质谱来进行相应的检测。
下图是蔗糖和乳糖,采用氨基柱的Hilic模式,糖类紫外没有吸收,选用示差折光检测器(RID),流动相乙腈/水=70:30能有比较好的保留和分离。
![]()
还有一点需要注意,极性分析物往往易溶于水,而我们采用Hilic模式分析时,极性样品溶于水后,要尽量用有机相去稀释,不然也会像反相模式一样产生溶剂效应,溶剂效用会随进样体积的增加愈加明显。

 上图中的三聚氰胺采用的是紫外检测器,选用200nm,末端吸收。而像糖类、氨基酸等大极性化合物往往是没有紫外吸收的,那就只能采用CAD、ELSD、RID或质谱来进行相应的检测。
上图中的三聚氰胺采用的是紫外检测器,选用200nm,末端吸收。而像糖类、氨基酸等大极性化合物往往是没有紫外吸收的,那就只能采用CAD、ELSD、RID或质谱来进行相应的检测。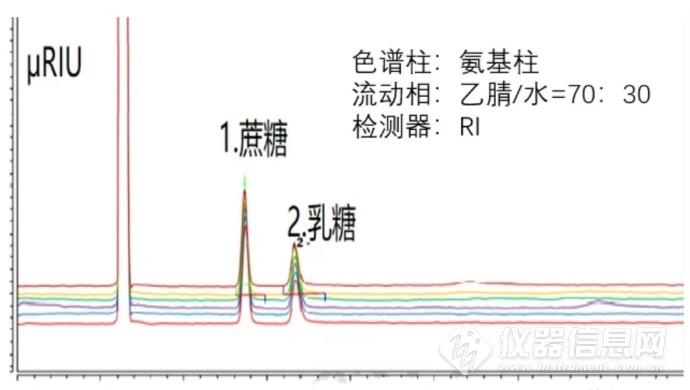 还有一点需要注意,极性分析物往往易溶于水,而我们采用Hilic模式分析时,极性样品溶于水后,要尽量用有机相去稀释,不然也会像反相模式一样产生溶剂效应,溶剂效用会随进样体积的增加愈加明显。
还有一点需要注意,极性分析物往往易溶于水,而我们采用Hilic模式分析时,极性样品溶于水后,要尽量用有机相去稀释,不然也会像反相模式一样产生溶剂效应,溶剂效用会随进样体积的增加愈加明显。