食品添加剂——红花黄肖淑玲2021.7
摘要:红花是菊科植物的干燥花,是具有多种疗效的名贵中草药。从红花中提取的红花黄色素不仅是重要的天然食用色素,也具有保护心脑血管、免疫抑制等多种药理功能,一直以来都是色素界的研究热点。本文从理化性质、稳定性、制备方法、应用研究及检测方法等多方面综述了红花黄色素,帮助读者全面了解红花黄色素,尤其是了解如何运用国标检测方法测定红花黄食品添加剂含量。关键词:食品添加剂,红花黄,色素1、
引言红花是中国重要的中草药,为菊科植物的干燥花,内含红花红色素和红花黄色素两种色素,其性温、味辛,具有活血通经、祛瘀止痛、降低胆固醇、降血压等功效,主要用于月经不调、痛经、经闭、跌打损伤,对冠心病、传染性肝炎等疾病亦有一定的疗效。红花黄色素是从红花的花瓣中提取出的天然黄色素,为查耳酮类化合物。红花黄色素是我国食用天然色素的一种,主要成分为红花黄色素A。研究发现红花黄色素不仅具有色泽艳丽、耐高压、耐低温、耐光、耐酸、耐还原和抗微生物等优点,而且还有扩张冠状动脉、抗氧化、保护心肌、降血压、免疫抑制和脑保护等多种药理功能,已经被归为国家级新药。红花黄色素因其优良的着色性能和独特的药理功能,一直在我国色素界大放异彩,饱受关注。2、
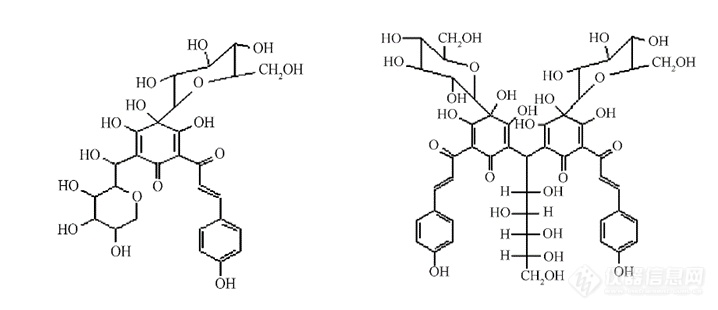
理化性质红花黄色素为黄色或棕黄色粉末,熔点230℃。它具有亲水性,易溶于水、稀乙醇、稀丙二醇,其水溶液呈鲜艳黄色,不产生沉淀,几乎不溶于无水乙醇,不溶于乙醚、石油醚、油脂、氯仿等有机溶剂。红花黄色素的颜色随pH 的不同而改变。在pH 值2-7范围的酸性溶液中颜色稳定性强,呈黄色;在碱性溶液中呈黄橙色,耐光性好,耐热性稍差。红花黄色素毒性极低、着色力强、色调稳定;在红花中含量为20% ~ 30%[1]。红花黄色素结构如下图一,为查耳酮类化合物。红花黄色素A分子式为C27H32O16,相对分子质量为612.5。红花黄色素B分子式为C48H54O27,相对分子质量为1062[2]。商品化的红花黄产品应以符合国家标准的红花黄为原料,可添加食用糊精等食品辅料而制成。![]()
图1.红花黄色素结构式:图左为红花黄色素A,图右为红花黄色素B[2]
3、
稳定性红花黄色素的稳定性,主要表现在其水溶性好、热稳定性好、金属离子对其影响小等多个方面。研究表明,红花黄色素易溶于水、稀乙醇等强极性溶剂,难溶于无水乙醇、丙酮等弱极性有机溶剂。光照或日晒对红花黄色素有一定的影响,应该避光保存。但它不受紫外光的影响,其耐光性较好。pH3. 4时,100°C加热1 h保存率在80%以上,说明其耐热性好[1]。但红花黄色素热稳定性不好,当温度高于60 °C, 加热一定时间后, 羟基红花黄色素A就会发生水解[3]。经Ca、Mg等金属离子对其影响的实验结果表明,Na+、Zn2+、Ca2+、Sn2+对色素有增色作用,色素对Fe3+、Cu2+、Vc较敏感。Fe2+对色素影响较大, 使其颜色变暗, 且吸光度峰值随Fe2+浓度增高而向紫外光移动, 还会产生乳浊液。蔗糖、淀粉、柠檬酸在短时间内能与色素共存,食盐、蔗糖、H2O2、抗坏血酸、亚硫酸钠等一定浓度的溶液除亚硫酸钠有轻微的减色作用,糖、盐等均有不同的增色作用。色素对氧化剂较稳定,但还原剂对色素影响较大。因此,建议在使用色素时应避免与还原剂一起使用。[1][4]提取方法对红花黄色素稳定性也有很大影响,红花黄色素不易在高温下提取或保存。黄宇玫等人[5]通过单因素和正交实验方法,对提取温度、浸取时间、溶剂用量进行考察,得出实验条件为:分别加20倍量的水提取2次, 在40 °C下, 2次浸取时间分别为12 h和4 h,过滤,合并滤液。在此实验条件下,红花黄色素具有较好的稳定性。文章也指出,目前除了采用上述的提取方法对色素进行提取以提高色素稳定性外, 主要的措施还有:加入稳定剂、抗氧化剂、金属离子封锁剂或天然色素的改性。开发新的提取方法对提高所得色素的稳定性也具有重要意义,如酶工程法得到的有效成分较其他方法就会更加稳定。4、
制备方法1.
传统方法传统的提取方法为:水提取法、有机溶剂沉淀精制法。主要操作方法就是把红花弄碎后用蒸馏水将其浸泡, 然后经过过滤, 得到浓缩液,将浓缩液中的沉淀与纯液体进行离心分离、干燥、粉碎。但是过去的实验已经发现应用传统的方式提取得到的成品的浓度不是很高, 含有很多的杂质, 不利于保存。经过不断的改进, 研究人员不断完善了传统的溶剂提取方法, 目前最理想的提取方法为:选择溶剂为pH 8.9的水溶液, 液料比25 mL/g,将红花放于73 °C下进行提取,一共要提取3次, 每次浸泡的时间一定要充足, 掌握在98min左右, 满足了这些提取条件, 得到的黄色素的成品质量很好[6]。2.
大孔吸附树脂法大孔吸附树脂是一类新型的非离子型有机高聚物吸附剂,它具有吸附容量大、选择性好、吸附速度快、解析容易、可反复使用等优点,目前作为理想的黄色素提取法在广泛应用中。彭永芳等人[7]研究发现将AB-8树脂作吸附剂, 洗脱剂用80 %的乙醇, 这样提取的成品质量较传统法好,产品杂质少,色价高,成本较低,工艺简单,收率高达干花重的23. 3 %。同时表明,AB-8树脂稳定性好,使用17次后其吸附率仅降低2. 32 % 。因此,该方法适合红花黄色素的分离纯化。3.
超声波辅助提取[8]红花黄色素在高温下不够稳定,超声辅助提取可以避免常规溶剂提取由于提取温度高对热不稳定性物质的破坏,且具有节能、省时、溶剂用量少、提取效率高等优点, 目前已被较多的应用于红花中黄色素的提取。肖艳华等人研究了红花中黄色素A的超声提取工艺,结果表明,影响红花黄色素A超声辅助提取因素的主次顺序为:超声时间>乙醇浓度>提取温度>溶剂用量,最佳提取工艺条件为:质量分数70 %乙醇为溶剂,提取温度50 °C,料液比1:10,超声时间20 min。此工艺条件下, 红花黄色素A的提取率为11.23 %。虽然超声辅助提取采用全物理过程, 无任何污染, 是一条理想的提取红花黄色素的途径, 但由于超声提取设备的研发相对滞后, 离实现大规模工业化生产还有较大距离。4.
微波辅助提取[8]微波辅助提取是基于微波具有良好的吸收性、穿透性,可对原料和提取溶剂均匀加热,从而加速活性成分的溶出。微波辅助提取红花黄色素不仅无污染、成本低、且提取率高、提取时间短、节约能源, 值得深入研究。但是加热时温度对活性成分或许有影响,仍需探索。5.
酶辅助提取[8]酶辅助提取利用各种酶有效分解原料的细胞壁及细胞间质中的纤维素、半纤维素和果胶等物质, 减少传质阻力, 促进活性成分的溶出。杜辉等采用1:1纤维素酶与果胶酶复合酶辅助提取红花中黄色素,通过响应面法分析得到:酶用量对红花黄色素提取率有极显著影响,pH、酶用量与酶解温度交互作用、pH与酶解温度交互作用对提取率有显著影响。其研究得出的优化提取工艺为:酶解温度47 °C, pH值4.7,酶解时间2.0 h,酶用量0.64%[9]。酶辅助提取方法具有提取率高、提取条件温和及有效成分理化性质稳定的特点。但是该方法相对成本较高,应用规模尚小。6.
闪式提取[8]闪式提取可在室温下, 依靠闪式提取器的高速机械剪切力和超动分子渗透技术,使活性成分快速达到在提取剂与原料组织中平衡,再通过过滤达到提取分离。具有溶剂用量少,快速、安全、节能、高效等优点, 极具开发应用前景。7.
减压提取[8]减压提取是一种新型提取方法,采用在常规提取器上加装真空系统的方法, 使提取操作在负压状态下进行,从而降低提取剂沸点,使提取剂在低温下沸腾,实现活性成分有效提取,并避免活性成分被破坏。减压提取可有效降低提取温度,缩短提取时间,成本低廉,有广阔的前景,有必要深入研究。5、
应用研究1.
食品着色红花黄色素作为一种天然、安全的食用色素,已成功应用于各种饮料、酒类及保健食品的着色。由于人工合成的柠檬黄为有毒色素,现已被许多国家禁止使用,红花黄色素可作为其首选色素,尤其是用于婴幼儿和老年保健食品。2.
纺织染色红花黄色素具有色泽艳丽和低毒等优点,在纺织业的染色中亦有出色应用。但红花黄色素提取、精制方法繁琐,生理功能机理研究不完善,因此离推广应用仍有很大距离。要想大规模应用,未来的研究重点应是简化工艺,提高产量,深入其功能机理研究。3.
医药疗效研究表明,红花黄色素具有抗炎、镇痛、抗氧化等多种疗效,在治疗心脑血管疾病、糖尿病、肿瘤等疾病方面也展现出了令人惊喜的药理潜力。红花黄色素目前已被归类为国家级新药,相信在未来会有更多与红花黄有关的药物面世。6、
用量要求《食品添加剂使用卫生标准》(GB2760-2011)规定:红花黄色素主要用于果味型饮料 (固体、液体)、果汁型饮料、汽水、各类果酒、配制酒、糖果、糕点上彩妆、红绿丝、果酱、水果罐头、冰制品、浓缩果汁、青梅、冰淇淋、冰棍、蜜饯和果冻,最大使用量为0.2 g/kg。7、
检测方法1.
高效液相色谱法(HPLC)已报道的红花黄色素含量测定方法主要为光度法、毛细管电泳法和HPLC法。光度法仅能测定黄色素总量,已报道的毛细管电泳法可测定Safflomin A,Safflomin C,Safflower yellow B三种黄色素。而王慧琴、谢明勇等人[10]用反相高效液相色谱法,梯度洗脱,同时测定了不同产地红花中Safflomin A、Safflower yellow A、Safflower yellow B和Safflomin C四种红花黄色素的含量。该方法准确度高, 重现性好。四种红花黄色素检出限分别4.0、8.1、2.8和5.0 mg/L。唐刚等人[11]用反相高效液相色谱法测定了红花W/O型乳膏剂中羟基红花黄色素A含量。检测结果显示,乳膏剂中辅料不影响有效成分羟基红花黄色素A的含量测定,该方法检测限为23.6 ng/mL,定量限为118 ng/mL。较之王慧琴等人的研究,其对于羟基红花黄素的测定更加精密准确。HPLC方法主要用于各品种红花、以红花黄为主要成分的乳膏、药丸、针剂等产品中红花黄色素含量的测定,食品中红花黄含量测定也可运用HPLC方法。此法具有高效、准确、重现性好等优点。但是HPLC方法也存在仪器贵重、操作复杂等局限。2.
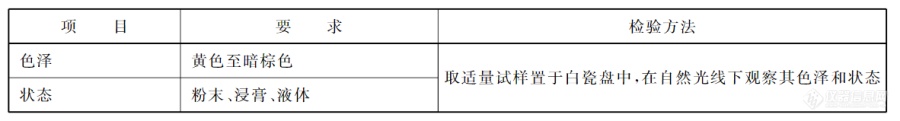
国家标准GB 1886.61-2015[2]食品中所用红花黄色素添加剂主要采用国家标准GB 1886.61-2015中规定的方法进行鉴别和测定,测定对象为从红花中提取的红花黄色素A和红花黄色素B样品。检测鉴定时应先测定并计算色价,计算方法见下文2.3。2.1技术要求红花黄色素感官要求应符合下表1:![]()
表1.红花黄感官要求[2]
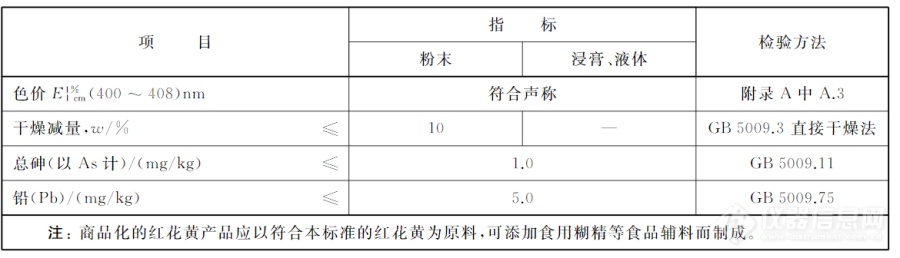
红花黄理化指标应符合下表2:![]()
表2.红花黄理化指标[2]
2.2
鉴别试验2.2.1溶解性试验红花黄易溶于水,微溶于乙醇,几乎不溶于乙醚,可通过溶解性试验鉴别。2.2.2吸光度(1)试剂与材料:柠檬酸-磷酸氢二钠缓冲溶液(pH 5.0):称取21 g一水合柠檬酸,溶于1000 mL水中,此为溶液A;称取71.6 g十二水合磷酸氢二钠,溶于1000 mL水中,此为溶液B;将溶液A与溶液B混合(97+103)。若混合液pH不为5.0,则用溶液A或溶液B调整至pH 5.0。(2)测定:称取质量相当于0.1 g、色价为10的试样,用柠檬酸-磷酸氢二钠缓冲溶液(pH 5.0)溶解并稀释至100 mL,此试样液在400-408 nm有最大吸收峰。2.2.3颜色反应在2.2.2的测定试样液中加入NaOH溶液(40 g/L),使溶液变为碱性,试样液色泽变为橙色。2.2.4薄层色谱称取质量相当于0.1 g、色价为10 的试样,用1 mL水溶解,加入10 mL甲醇混匀,3000 r/min离心10 min,取上清液20 μL,点样于微晶纤维素薄层色谱板(预先在60-80°C下活化20 min)上,干燥,置于展开剂(正丁醇:乙酸:水=4:1:2)中展开。当溶剂前沿上升至距原点约10 cm时,取出薄板,在空气中干燥。薄板上至少有两个黄色斑点,Rf值应在0.2-0.5之间。2.3色价(400-408 nm)的测定2.3.1仪器与材料(1)仪器与设备:分光光度计(2)试剂与材料:柠檬酸-磷酸氢二钠缓冲溶液(pH 5.0):称取21 g一水合柠檬酸,溶于1000 mL水中,此为溶液A;称取71.6 g十二水合磷酸氢二钠,溶于1000 mL水中,此为溶液B;将溶液A与溶液B混合(97+103)。若混合液pH不为5.0,则用溶液A或溶液B调整至pH 5.0。2.3.2分析步骤称取试样约0.1 g,精确到0.0002 g,用柠檬酸-磷酸氢二钠缓冲溶液(pH 5.0)溶解,定容至1000 mL,摇匀,必要时过滤。取此试样置于1 cm比色皿中,以柠檬酸-磷酸氢二钠缓冲溶液(pH 5.0)为空白对照,用分光光度计在400-408 nm内的最大吸收波长处测定其吸光度(吸光度应控制在0.2-0.8之间,否则应调整试样液浓度后重新测定)。2.3.3结果计算色价(400-408 nm)计算式如下:(400-408 nm)=式中:A——实测试样液吸光度;c——被测试样液浓度,单位为g/mL;100——浓度换算系数。试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的5%。8、
结语随着柠檬黄等合成色素对人体和环境的危害日益引起人们的重视,合成色素退出色素市场已成趋势,人们的目光重新转向安全可靠的天然色素。开发可大规模应用的安全的天然色素对保护人体健康和推进食品工业发展都具有重大意义。红花广泛分布于我国境内,主产河南、湖南、四川、新疆、西藏等地,自古以来就是重要的中草药,也是古代胭脂的主要着色剂。红花黄色素着色能力强,色泽鲜艳,低毒且稳定,又具有独特的药用价值,市场前景极为广阔。近年来,对红花黄色素的研究不断深入,科研工作者们研究了其稳定性的影响因素与控制方法,开发了多种高效、快速、安全、稳定的提取方法,酶工程法等方法都具有广阔的前景,发展了光度法、HPLC等多种含量测定方法。针对红花黄色素的生理活性和药理功能的研究也不断深入,红花黄色素在治疗心脑血管疾病和抗癌方面的疗效令人惊喜。
但是,红花黄色素的许多提取方法都尚未能大规模投入工业生产,传统方法繁琐复杂产率低,大大限制了红花黄色素的进一步发展。红花黄色素的生理功能机理研究也并不完善。但是随着研究的不断推进,相信在不久的将来,红花黄色素会突破这些界限,为天然色素领域做出更大的贡献。
参考文献:[1]许钢.天然红花黄色素稳定性研究[J].食品工业科技,2000(01):16-18.[2]中华人民共和国国家标准GB 1886.61-2015.[3]王慧,张立伟,晋民杰,苏尚宏.羟基红花黄色素A稳定性研究[J].太原科技大学学报,2010,31(01):81-84.[4]吴冬青,林敏,王学文,许莹堂,张爱平,史茂才,陈桂花.红花黄色素稳定性研究[J].河西学院学报,2003(05):32-36.[5]罗晶,黄宇玫,曾文雪.红花中羟基红花黄色素A的提取工艺及其热稳定性研究[J].江西中医学院学报,2009,21(05):39-42.[6]魏安池,代红丽,谷文英. 响应面分析法优化红花黄色素提取工艺条件[ J] . 食品与机械,2006,22( 2) :11- 14.[7]彭永芳,马银海,阎孝金,等. AB-8树脂吸附和分离红花黄色素[ J] . 食品科学,2001,22( 5):39- 41.[8]展俊岭,高子怡,皇甫阳鑫,赵三虎,赵二劳.红花黄色素提取工艺研究进展[J].山东化工,2017,46(18):67+75.[9]杜辉,马永强,李春阳,李波,刘晓林.响应面法优化复合酶提取红花黄色素工艺[J].南方农业学报,2015,46(04):657-663.[10]王慧琴,谢明勇,傅博强.红花中红花黄色素含量的反相高效液相色谱测定[J].分析科学学报,2005(04):408-410.[11]唐刚,金坚,杨子毅.RP-HPLC测定红花W/O型乳膏剂中羟基红花黄色素A的含量[J].中国药科大学学报,2020,51(02):161-167.